
【题目】2016年7月报道,南开大学科研团队在“可充室温钠-二氧化碳电池”的研究中取得突破进展,该电池放电时工作情况如图所示。下列说法错误的是

A. 金属Na为电池的负极
B. 放电时,电解液中Na+向碳电极移动
C. 充电时,碳电极发生的反应为:4Na++4e-+3CO2== 2Na2CO3+C
D. 放电时,每转移2 mol电子,消耗标准状况下的CO2 33.6 L
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】今年6月20日,2016年全球最受关注的十大化学成果发布,其中有两项与空气中的二氧化碳处理利用技术有关。其一为美国伊利诺斯大学芝加哥分校和阿贡国家实验室科学家联合设计的新型太阳能电池,可直接把大气中的二氧化碳转化为合成气(CO和H2)该设计同时具有环保和经济价值,不仅可以减缓二氧化碳的排放,而且可以生成重要的化工原料。
(1)下列材料也可以用于制造太阳能电池的是____________。
A.Ag2O B.Fe3O4 C.Si D.SiO2
(2)下图装置可实现二氧化碳到一氧化碳的转化
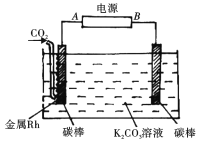
①电源的正极为______(“A”或“B")。
②阴极发生反应的电极方程式为:___________.
(3)CO 和H2可用于合成甲醇。
①已知CO、H2、CH3OH(1)的燃烧热为283.0kJ/mol、285.8kJ/mol、726.5kJ/mol,写出 由CO和H2制备CH3OH(1)的热化学方程式__________。
②在398K,1L的恒容容器中充入0.1molCO和0.2molH2,发生反应CO(g)+2H2(g) ![]() CH3OH(g),反应过程中气体的压强如下表所示(atm为标准大气压)。
CH3OH(g),反应过程中气体的压强如下表所示(atm为标准大气压)。
时间(min) | 0 | 1 | 5 | 10 | 30 | 50 |
压强(atm) | 10 | 9.3 | 8.0 | 7.2 | 4 | 4 |
该温度下的平衡常数是_____。达到平衡后,向该容器中通入0.05mol的气态CH3OH,再次达到平衡时,CH3OH的体积分数比原平衡时_____( 填“大”或“小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质在一定条件下具有如下图所示的转化关系,下列判断错误的是

A. 若图中反应均为非氧化还原反应,当W为一元强碱时,则Z可能是NaAlO2
B. 若图中反应均为氧化还原反应,当W为非金属单质时,则Z可能是CO2
C. 若图中反应均为非氧化还原反应,当W为一元强酸时则X可能是NH3
D. 若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是FeCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸的结构简式为![]() ,下列说法正确的是( )
,下列说法正确的是( )
A. 1mol苹果酸与足量金属Na反应生成1mol![]()
B. 1mol苹果酸可与3molNaOH发生中和反应
C. 苹果酸中能发生酯化反应的官能团有2种
D. ![]() 与苹果酸互为同分异构体
与苹果酸互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期主族元素X、Y、Z、R、T,R原子的最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Y与T同主族。五种元素原子半径与原子序数之间的关系如图所示。下列推断正确的是( )
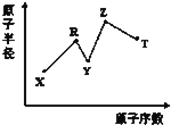
A. 离子半径:Y<Z
B. 氢化物的沸点:Y<T
C. 最高价氧化物对应水化物的酸性:T<R
D. 由X、Y、Z、R四种元素组成的常见化合物中含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列判断正确的是
A. 常温下,pH=1的盐酸溶液中,由水电离的H+个数为10-13NA
B. 标准状况下,氧原子总数为0.2NA的CO2和NO2的混合气体,其体积为2.24L
C. 常温下,5.6g铁分别与足量氯气和浓硝酸反应,转移的电子数目均为0.3NA
D. 100g46%(质量分数)乙醇溶液中所含O-H数目为7NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素砷(As)的原子序数为33,下列叙述正确的是( )
A. 砷元素的最高化合价为+3价
B. 砷原子的第三电子层含有8个电子
C. 砷元素是第四周期的主族元素
D. 砷的氧化物的水溶液呈强碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com