
【题目】氢是宇宙中含量最高的元素,占宇宙总质量的75%,应用前景十分广阔。
(1)氢有1H、2H、3H三种常见的核素,它们互称为____;氢元素的相对原子质量约为1.008,则三种核素中丰度(百分含量)最高的是____。
(2)2H2O可用作核反应堆的减速剂,1个 2H2O分子中所含中子的个数为___。
(3)H可与N形成多种分子,其中某分子含18个e-、6个原子,则该分子的结构式为__。
(4)工业上用C和H2O制取H2。已知:
①C(s) + H2O(g) = H2(g) + CO(g) ΔH1 ②C(s) + 2H2O(g) = 2H2(g) + CO2(g) ΔH2
则CO(s) + H2O(g) = H2(g) + CO2(g) ΔH =__(用ΔH1、ΔH2表示)。
(5)NaBH4是一种重要的储氢载体。
①B在元素周期表中的位置为___。
②NaBH4(s)与H2O (l)反应生成NaBO2(s)和一种气体,在25℃,101kPa下,已知每消耗3.8g NaBH4放热21.6kJ,则该反应的热化学方程式为________;反应前后B的化合价不变,则反应消耗1molNaBH4时转移的电子数目为____。
【答案】同位素 1H 10 ![]() ΔH2-ΔH1 第二周期第IIIA族 NaBH4(s)+2H2O(l)=NaBO2(s)+4H2(g) ΔH=-216kJ·mol-1 4NA
ΔH2-ΔH1 第二周期第IIIA族 NaBH4(s)+2H2O(l)=NaBO2(s)+4H2(g) ΔH=-216kJ·mol-1 4NA
【解析】
(1)1H、2H、3H的质子数相同,中子数不相同,所以它们互为同位素,同位素在自然界中的丰度,指的是该同位素在这种元素的所有天然同位素中所占的比例,氢元素的相对原子质量约为1.008,与1H的质量数比较接近,则三种核素中丰度(百分含量)最高的是1H,故答案为:同位素,1H。
(2)中子数=质量数-质子数,2H的中子数=2-1=1,O的中子数=16-8=8,所以1个2H2O分子中所含中子的个数为1+1+8=10,故答案为:10。
(3)H可与N形成多种分子,其中含18个e-、6个原子的分子为N2H4,N2H4中N原子与其它三个原子成键,达到8电子稳定结构,结构式为![]() ,故答案为:
,故答案为:![]() 。
。
(4)已知:①C(s)+H2O(g)=H2(g)+CO(g) ΔH1②C(s) +2H2O(g)=2H2(g)+CO2(g) ΔH2,根据盖斯定律由②-①可得,CO(s)+H2O(g)=H2(g)+CO2(g) ΔH=ΔH2-ΔH1,故答案为:ΔH2-ΔH1。
(5)①B的原子序数为5,在元素周期表中的位置为第二周期第IIIA族,故答案为:第二周期第IIIA族。
②NaBH4能与水反应生成NaBO2,且反应前后B的化合价不变,所以NaBH4与H2O发生反应,生成NaBO2和氢气,H元素化合价由-1价、+1价变为0价,依据得失电子守恒可知:NaBH4的系数为1,H2O的系数为2,依据原子个数守恒,反应方程式:NaBH4+2H2O=NaBO2+4H2↑,已知每消耗3.8gNaBH4放热21.6kJ,3.8gNaBH4的物质的量为0.1mol,所以1molNaBH4参加反应放出的热量为216kJ,故该反应的热化学方程式为:NaBH4(s)+2H2O(l)=NaBO2(s)+4H2(g) ΔH=-216kJ·mol-1,根据反应方程式,1个NaBH4参加反应转移4个电子,则反应消耗1molNaBH4时转移的电子数目为4NA,故答案为:NaBH4(s)+2H2O(l)=NaBO2(s)+4H2(g) ΔH=-216kJ·mol-1;4NA。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列判断正确的是
A. 常温下,pH=1的盐酸溶液中,由水电离的H+个数为10-13NA
B. 标准状况下,氧原子总数为0.2NA的CO2和NO2的混合气体,其体积为2.24L
C. 常温下,5.6g铁分别与足量氯气和浓硝酸反应,转移的电子数目均为0.3NA
D. 100g46%(质量分数)乙醇溶液中所含O-H数目为7NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的短周期主族元素。已知W原子的最外层电子数是电子层数的2倍,Y原子次外层电子数与其它各层电子总数相等,W和X的原子序数之和等于Z的原子序数。下列说法正确的是
A. 含氧酸的酸性:Z>W
B. 在一定条件下W的单质能与Y的最高价氧化物对应的水化物反应
C. 四种元素均能与氢元素形成共价键
D. 简单离子半径:X>Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A. 0.1 mol![]() 所含电子的数目为1.4NA
所含电子的数目为1.4NA
B. 32gS8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
C. 14gLi在空气中充分燃烧,消耗氧分子的数目为NA
D. 标准状况下,11.2LCl2溶于水,溶液中Clˉ、ClOˉ和HClO的微粒数之和小于NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置:
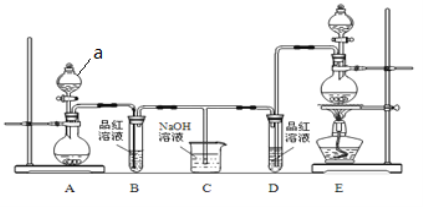
(1)仪器a的名称是____。
(2)利用图中A装置进行实验室制备SO2的化学方程式是____。
(3)反应开始后,发现B、D两个试管中的品红溶液都褪色。停止通气后,给B、D两支试管中的液体加热,试管中现象是:B__;D___。据此,说明SO2的漂白特点是_____。
(4)装置C的作用是_______。
(5)将等物质的量的SO2和Cl2同时通入水中,所得水溶液没有漂白性的原因是(用离子方程式表示)________。要检验此时溶液中生成的负一价阴离子,方法是_____(要求答出具体实验操作、现象及结论)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素砷(As)的原子序数为33,下列叙述正确的是( )
A. 砷元素的最高化合价为+3价
B. 砷原子的第三电子层含有8个电子
C. 砷元素是第四周期的主族元素
D. 砷的氧化物的水溶液呈强碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1000 mol·L-1NaOH溶液分别滴定20.00ml 0.1000 mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )

A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.pH=7时,滴定盐酸和醋酸消耗NaOH溶液的体积相等
C.V(NaOH) =10.00mL时,醋酸溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.V(NaOH) =20.00mL时,两溶液中 c(CH3COO-)>c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化关系,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化关系,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
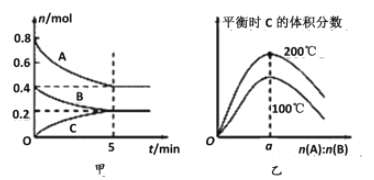
A. 200℃时,反应从开始到平衡的平均速率v(A)=v(B)
B. 200℃时,该反应的平衡常数为25
C. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D. 由图乙可知,反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com