
【题目】在容积为2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化关系,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化关系,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
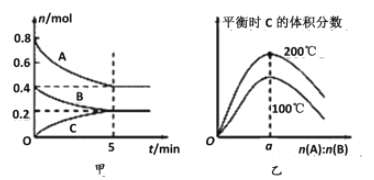
A. 200℃时,反应从开始到平衡的平均速率v(A)=v(B)
B. 200℃时,该反应的平衡常数为25
C. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D. 由图乙可知,反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
【答案】B
【解析】
A项,由图甲,200℃时,反应从开始到平衡的平均速率v(A)=(0.8-0.4)÷2L÷5min=0.04molL-1min-1,v(B)=(0.4-0.2)mol÷2L÷5min=0.02molL-1min-1,所以v(A)≠v(B),故A错误;B项,由图甲数据可知反应的A、B与生成的C的物质的量之比为=(0.8-0.4):(0.4-0.2):0.2=2:1:1,所以该反应的化学方程式为2A+B![]() C,A、B、C的平衡浓度分别为:c(A)=(0.8-0.4)÷2L=0.2molL-1,c(B)=(0.4-0.2)÷2L=0.1molL-1,c(C)=0.2÷2L=0.1molL-1,K=
C,A、B、C的平衡浓度分别为:c(A)=(0.8-0.4)÷2L=0.2molL-1,c(B)=(0.4-0.2)÷2L=0.1molL-1,c(C)=0.2÷2L=0.1molL-1,K=![]() =
=![]() =25,故B正确;C项,当外界条件由200℃降温到100℃,化学平衡常数发生变化,原平衡一定被破坏,正逆反应速率均减小,故C错误;D项,前面已推出该反应的方程式为2A+B
=25,故B正确;C项,当外界条件由200℃降温到100℃,化学平衡常数发生变化,原平衡一定被破坏,正逆反应速率均减小,故C错误;D项,前面已推出该反应的方程式为2A+B![]() C,只有当两种反应物按照化学方程式的计量数之比加入时生成物C达到平衡时含量才会最高,故a=2,由图乙可知:升高温度,平衡时C的体积分数增大。说明升高温度化学平衡向正反应方向移动,所以正反应为吸热反应,△H>0,故D错误。
C,只有当两种反应物按照化学方程式的计量数之比加入时生成物C达到平衡时含量才会最高,故a=2,由图乙可知:升高温度,平衡时C的体积分数增大。说明升高温度化学平衡向正反应方向移动,所以正反应为吸热反应,△H>0,故D错误。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】氢是宇宙中含量最高的元素,占宇宙总质量的75%,应用前景十分广阔。
(1)氢有1H、2H、3H三种常见的核素,它们互称为____;氢元素的相对原子质量约为1.008,则三种核素中丰度(百分含量)最高的是____。
(2)2H2O可用作核反应堆的减速剂,1个 2H2O分子中所含中子的个数为___。
(3)H可与N形成多种分子,其中某分子含18个e-、6个原子,则该分子的结构式为__。
(4)工业上用C和H2O制取H2。已知:
①C(s) + H2O(g) = H2(g) + CO(g) ΔH1 ②C(s) + 2H2O(g) = 2H2(g) + CO2(g) ΔH2
则CO(s) + H2O(g) = H2(g) + CO2(g) ΔH =__(用ΔH1、ΔH2表示)。
(5)NaBH4是一种重要的储氢载体。
①B在元素周期表中的位置为___。
②NaBH4(s)与H2O (l)反应生成NaBO2(s)和一种气体,在25℃,101kPa下,已知每消耗3.8g NaBH4放热21.6kJ,则该反应的热化学方程式为________;反应前后B的化合价不变,则反应消耗1molNaBH4时转移的电子数目为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列制备和收集气体的实验装置合理的是( )
A. 用氯化铵和氢氧化钙制NH3 
B. 用MnO2 和浓盐酸制氯气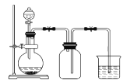
C. 用锌粒和稀硫酸制氢气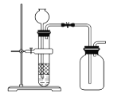
D. 用双氧水和二氧化锰制氧气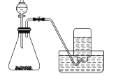
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组能够大量共存的是
A. Fe3+、SO42-、NH4+、SCN- B. Fe2+、Cl-、Ba2+、OH-
C. Na+、Mg2+、Cl-、SO42- D. H+、Fe2+、Cl-、NO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质全部是弱电解质的是( )
A.H2SiO3 H2S CO2B.MgSO4 CH3COOH CH3CH2OH
C.H2SO3 Ca(OH)2 CH3COOHD.H2O NH3H2O H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物貭的量之向的关系如图所示。则下列説法正确的是( )

A. 溶液中的阳离子一定含有H+、Mg2+、Al3+,可能含有Fe3+
B. 溶液中一定不含CO32-和NO3-,一定含有SO42-
C. 溶液中C(NH4+)=0.2mol/L
D. c(H+):c(Al3+):c(Mg2+)=l:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有以下各组微粒或物质:A.正丁烷和异丁烷;B.金刚石、石墨和C60;C.冰和干冰;D.35Cl和37Cl;E.NO和NO2;其中,互为同分异构体的有__________(填编号,以下同);互为同素异形体的有__________;互为同位素的有__________。
(2)现有:①干冰;②金刚石;③NH4Cl;④Na2S四种物质,按下列要求回答(填序号):熔化时不需要破坏化学键的是____________;既存在离子键又存在共价键的是____________。
(3)向一个容积为2 L的密闭容器中充入7 mol SO2和4 mol O2,在一定温度和压强下,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g),经4 s后达到平衡状态,测得SO2的物质的量是3 mol,则达到平衡状态时O2的转化率为__________;平衡时SO3的物质的量浓度_______。
2SO3(g),经4 s后达到平衡状态,测得SO2的物质的量是3 mol,则达到平衡状态时O2的转化率为__________;平衡时SO3的物质的量浓度_______。
(4)NaBH4(s)与H2O(l)反应生成NaBO2(s)和氢气,在25℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组模拟工业制漂白粉,设计了下列图的实验装置。已知:①氯气和碱反应放出热量。②6Cl2+6Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O。
5CaCl2+Ca(ClO3)2+6H2O。
回答下列问题:
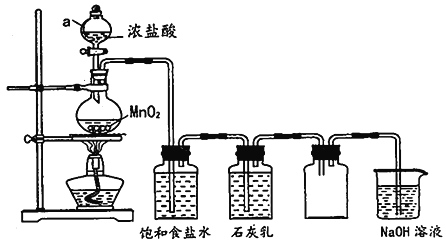
(1)甲装置中仪器a的名称是_____________________。
(2)装置乙中饱和食盐水的作用是_____________________。
(3)①制取漂白粉的化学方程式是______________________________。
②该小组制得的漂白粉中n(CaCl2)远大于n[Ca(ClO)2],则产物中还混杂有物质的化学式是_____。
③为提高Ca(ClO)2的含量,可采取的措施是__________________(任写一种即可)。
(4)漂白粉应密封保存,原因是______________(用化学方程式表示)。
(5)家庭中常用84 消毒液(主要成分NaClO)、洁厕灵(主要成分盐酸)清洁卫生。两者同时混合使用会产生有毒的氯气,写出该反应的离子方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物能形成酸雨和光化学烟雾,严重污染环境。燃煤和机动车尾气是氮氧化物的主要来源。现在对其中的一些气体进行了一定的研究:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) △H= 574 kJ·moll
4NO(g)+CO2(g)+2H2O(g) △H= 574 kJ·moll
②CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) △H= 1160 kJ·moll
2N2(g)+CO2(g)+2H2O(g) △H= 1160 kJ·moll
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式______________________________________________________。
(2)在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体。T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,在一定条件下发生反应,反应过程中NO的物质的量随时间变化如图所示。
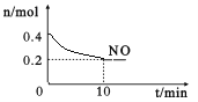
①写出该反应的化学方程式______________________________________。
②10 min内该反应的速率v(CO)=__________________;T℃时,该化学反应的平衡常数K=_______。
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____________。(填序号)
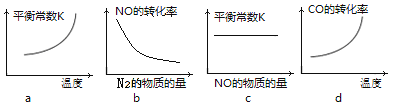
④一定温度下,在恒容密闭容器中充入一定量NO和CO进行该反应,下列选项能判断反应已达到化学平衡状态的是____________。
a.容器中压强不再变化 b.CO2的浓度不再变化
c.2v正(NO)=v逆(N2) d.气体的密度不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com