
【题目】(1)有以下各组微粒或物质:A.正丁烷和异丁烷;B.金刚石、石墨和C60;C.冰和干冰;D.35Cl和37Cl;E.NO和NO2;其中,互为同分异构体的有__________(填编号,以下同);互为同素异形体的有__________;互为同位素的有__________。
(2)现有:①干冰;②金刚石;③NH4Cl;④Na2S四种物质,按下列要求回答(填序号):熔化时不需要破坏化学键的是____________;既存在离子键又存在共价键的是____________。
(3)向一个容积为2 L的密闭容器中充入7 mol SO2和4 mol O2,在一定温度和压强下,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g),经4 s后达到平衡状态,测得SO2的物质的量是3 mol,则达到平衡状态时O2的转化率为__________;平衡时SO3的物质的量浓度_______。
2SO3(g),经4 s后达到平衡状态,测得SO2的物质的量是3 mol,则达到平衡状态时O2的转化率为__________;平衡时SO3的物质的量浓度_______。
(4)NaBH4(s)与H2O(l)反应生成NaBO2(s)和氢气,在25℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是____________________________。
【答案】ABD①③50%2 mol·L-1NaBH4(s)+2H2O(l)==NaBO2(s)+4H2(g) ΔH=-216.0kJ·mol-1
【解析】
(1)同分异构体是指分子式相同,但结构不同的有机化合物,而同素异形体是指由同种元素组成的不同单质,质子数相同而中子数不同的同一种元素的不同核素互为同位素;
(2)分子晶体熔化不需要破坏化学键,原子晶体熔化时需要破坏共价键,离子晶体熔化时需要破坏离子键;共价键为非金属原子之间通过共用电子对形成的化学键,离子键为阴阳离子之间通过静电作用形成的化学键,根据物质的组成进行判断;
(3)根据反应中变化的物质的量之比等于化学计量数之比,求出反应的氧气的物质的量,然后根据转化率=转化量/起始量×100%来解答;根据方程式计算出SO3的物质的量,再利用c=n÷V计算SO3的物质的量浓度。
(4)在25℃、101 kPa下,已知每消耗0.1mol NaBH4(s)放热21.6 kJ,则消耗1mol NaBH4放热216.0kJ,结合物质的状态、焓变书写热化学方程式。
(1)A、正丁烷和异丁烷的分子式都是C4H10,但结构不同,则互为同分异构体;
B、金刚石、石墨和C60都是由碳元素组成的不同单质,则互为同素异形体;
C、冰和干冰的成分分别是水、二氧化碳,是两种不同的物质;
D、35Cl和37Cl是质子数相同,中子数不同的原子,则为同种元素的不同核素,互为同位素;
E、NO和NO2是两种不同的物质;因此答案是A;B;D;
(2)分子晶体熔化不需要破坏化学键,所以熔化时不需要破坏化学键的是干冰;金刚石、NH4Cl、Na2S分别属于原子晶体、离子晶体、离子晶体,熔化时需要破坏共价键、离子键、离子键;干冰中碳氧之间形成共价键;金刚石中碳碳之间形成共价键;NH4Cl中氯离子和铵根离子之间存在离子键,铵根离子中氮原子和氢原子之间存在共价键;Na2S中钠离子与硫离子之间形成离子键,因此答案是①;③;
(3)向一个容积为2L的密闭容器中充入7 mol SO2和4 mol O2,在一定温度和压强下,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g),经4s后达到平衡状态,测得SO2的物质的量是3mol,则反应的SO2的物质的量是4mol,反应中变化的物质的量之比等于化学计量数之比,所以消耗的氧气的物质的量为2mol,因此平衡状态时O2的转化率为2mol/4mol×100%=50%;参加反应的SO2的物质的量为7mol-3mol=4mol,根据方程式2SO2(g)+O2(g)
2SO3(g),经4s后达到平衡状态,测得SO2的物质的量是3mol,则反应的SO2的物质的量是4mol,反应中变化的物质的量之比等于化学计量数之比,所以消耗的氧气的物质的量为2mol,因此平衡状态时O2的转化率为2mol/4mol×100%=50%;参加反应的SO2的物质的量为7mol-3mol=4mol,根据方程式2SO2(g)+O2(g)![]() 2SO3(g)可以知道生成的SO3的物质的量等于参加反应的SO2的物质的量,平衡时SO3的物质的量浓度为4mol÷2L=2mol/L;
2SO3(g)可以知道生成的SO3的物质的量等于参加反应的SO2的物质的量,平衡时SO3的物质的量浓度为4mol÷2L=2mol/L;
(4)n(NaBH4)=3.8g÷38g/mol=0.1mol,在25 ℃、101 kPa下,已知每消耗0.1mol NaBH4(s)放热21.6 kJ,则消耗1mol NaBH4放热216.0kJ,因此反应的热化学方程式为NaBH4(s)+2H2O(l)=NaBO2(s)+4H2(g) ΔH=-216.0kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】已知元素砷(As)的原子序数为33,下列叙述正确的是( )
A. 砷元素的最高化合价为+3价
B. 砷原子的第三电子层含有8个电子
C. 砷元素是第四周期的主族元素
D. 砷的氧化物的水溶液呈强碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 |
下列说法正确的是( )
A. 由实验数据可知实验控制的温度T2>T1
B. 组别①中,0~20min内,NO2的降解速率为0.0125mol·L-1·min-1
C. 40min时,表格中T2对应的数据为0.18
D. 0~10min内,CH4的降解速率①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化关系,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化关系,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
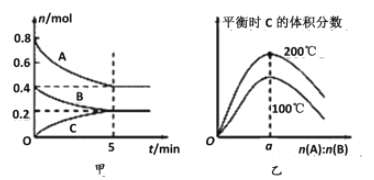
A. 200℃时,反应从开始到平衡的平均速率v(A)=v(B)
B. 200℃时,该反应的平衡常数为25
C. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D. 由图乙可知,反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四个体积相同的密闭容器中,在一定条件下发生反应:反应开始时,反应速率最大的是
容器 | 温度 | N2(mol) | H2(mol) | 催化剂 |
A | 500 | 2 | 6 | 有 |
B | 500 | 1.5 | 4.5 | 无 |
C | 450 | 1.5 | 4.5 | 无 |
D | 450 | 2 | 6 | 无 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。通过对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
(1)已知:H2的燃烧热为285.8 kJ·mol-1 H2O(g)=H2O(l) ΔH=-44 kJ/mol
N2(g)+2O2(g)=2NO2(g) ΔH=+133 kJ/mol
①在催化剂存在下,H2还原NO2生成水蒸气和另一种无毒物质的热化学方程式为:___________________________________。
②反应2NO2(g )=N2(g)+2O2(g),设起始时容器中只有NO2,平衡时三种物质的物质的量与温度关系如图所示。
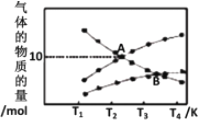
则A点时,NO2的转化率为_______________。
B点时,设容器的总压为a Pa,则平衡常数Kp为____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)向2 L密闭容器中加入2 mol CO2和6 mol H2,在适当的催化剂作用下,下列反应能自发进行:CO2(g)+3H2(g)![]() CH3OH(g) +H2O(g)。
CH3OH(g) +H2O(g)。
①该反应ΔH_______0(填“>”、“<”或“=”)
②下列叙述能说明此反应达到平衡状态的是____________。(填字母)
a.混合气体的平均相对分子质量保持不变
b.1 mol CO2生成的同时有3 mol H—H键断裂
c.CO2的转化率和H2的转化率相等
d.混合气体的密度保持不变
③反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在起始温度(T1℃)、体积相同(2L)的两密闭容器中,改变条件,反应过程中部分数据见下表:
CH3OH(g)+H2O(g),在起始温度(T1℃)、体积相同(2L)的两密闭容器中,改变条件,反应过程中部分数据见下表:
反应时间 | CO2/mol | H2/mol | CH3OH/mol | H2O/mol | |
反应Ⅰ:恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
10 min | 4.5 | ||||
20 min | 1 | ||||
30 min | 1 | ||||
反应Ⅱ:绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
反应Ⅰ,前10min内的平均反应速率v(CH3OH)=____________。达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)____________K(II)(填“>”、“<”或“=”);平衡时CH3OH的浓度c(I)____________c(II)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在3L密闭容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据
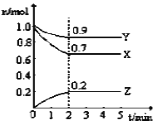
(1)该反应的化学方程式为:______
(2)反应开始至2min,用X表示的平均反应速率为:______;平衡时,Y的转化率为______;平衡时,Y的浓度为______;
(3)在密闭容器里,通入a mol X(s)和b mol Y(g),发生反应X(s)+Y (g)2Z(g),当改变下列条件时,反应速率会发生什么变化(选填“增大”、“减小”或“不变”)
①增加X(s)的质量:______
②增大容器的体积:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,一定体积的容器加入一定量的A(s)发生反应:3A(s) ![]() B(g) +2C(g),下列描述中能说明该反应达到平衡的是
B(g) +2C(g),下列描述中能说明该反应达到平衡的是
① v(B)逆=2 v(C)正 ②单位时间内生成 a mol B,同时消耗 2a mol C
③容器中的压强不再变化 ④混合气体的密度不再变化
⑤B的体积分数不再变化 ⑥混合气体的平均相对分子质量不再变化
A. ①②③B. ②③④C. ④⑤D. ①⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电子式书写正确的是( )
①钠离子[Na]+ ②过氧根离子![]() ③氢氧根离子
③氢氧根离子![]()
④氧原子![]() ⑤氢离子H+ ⑥铵根离子
⑤氢离子H+ ⑥铵根离子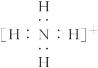
⑦铝原子Al ⑧溴离子![]()
A. ②③④⑥⑦B. ①③④⑥⑦⑧
C. ③④⑤⑥⑧D. ②③④⑦⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com