
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。通过对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
(1)已知:H2的燃烧热为285.8 kJ·mol-1 H2O(g)=H2O(l) ΔH=-44 kJ/mol
N2(g)+2O2(g)=2NO2(g) ΔH=+133 kJ/mol
①在催化剂存在下,H2还原NO2生成水蒸气和另一种无毒物质的热化学方程式为:___________________________________。
②反应2NO2(g )=N2(g)+2O2(g),设起始时容器中只有NO2,平衡时三种物质的物质的量与温度关系如图所示。
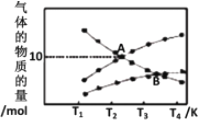
则A点时,NO2的转化率为_______________。
B点时,设容器的总压为a Pa,则平衡常数Kp为____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)向2 L密闭容器中加入2 mol CO2和6 mol H2,在适当的催化剂作用下,下列反应能自发进行:CO2(g)+3H2(g)![]() CH3OH(g) +H2O(g)。
CH3OH(g) +H2O(g)。
①该反应ΔH_______0(填“>”、“<”或“=”)
②下列叙述能说明此反应达到平衡状态的是____________。(填字母)
a.混合气体的平均相对分子质量保持不变
b.1 mol CO2生成的同时有3 mol H—H键断裂
c.CO2的转化率和H2的转化率相等
d.混合气体的密度保持不变
③反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在起始温度(T1℃)、体积相同(2L)的两密闭容器中,改变条件,反应过程中部分数据见下表:
CH3OH(g)+H2O(g),在起始温度(T1℃)、体积相同(2L)的两密闭容器中,改变条件,反应过程中部分数据见下表:
反应时间 | CO2/mol | H2/mol | CH3OH/mol | H2O/mol | |
反应Ⅰ:恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
10 min | 4.5 | ||||
20 min | 1 | ||||
30 min | 1 | ||||
反应Ⅱ:绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
反应Ⅰ,前10min内的平均反应速率v(CH3OH)=____________。达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)____________K(II)(填“>”、“<”或“=”);平衡时CH3OH的浓度c(I)____________c(II)(填“>”、“<”或“=”)。
【答案】4H2(g)+2NO2(g)=N2(g)+4H2O(g) △H=-1100.2kJ·mol-1 50% a Pa < a b 0.025 mol·L-1 ·min-1 > >
【解析】
(1)①已知:H2的燃烧热为285.8kJmol-1,则H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJmol-1,又因为H2O(g)=H2O(l) ΔH=-44 kJ/mol,N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ/mol,上述三个方程式分别标为Ⅰ、Ⅱ、Ⅲ,根据盖斯定律,Ⅰ×4-Ⅱ×4-Ⅲ可得到在催化剂存在下H2还原NO2生成水蒸气和其它无毒物质的热化学方程式4H2(g)+2NO2(g)=N2(g)+4H2O(g) △H=-1100.2kJmol-1。②根据化学方程式及图示数据,A点时NO2是10mol,O2是10mol,N2是5mol,所以NO2初始物质的量是20mol,则NO2的转化率为50%;B点时NO2和N2物质的量相等,设为xmol,则O2是2xmol,因为容器的总压为a Pa,所以NO2和N2的分压都是
O2(g)=H2O(l) △H=-285.8kJmol-1,又因为H2O(g)=H2O(l) ΔH=-44 kJ/mol,N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ/mol,上述三个方程式分别标为Ⅰ、Ⅱ、Ⅲ,根据盖斯定律,Ⅰ×4-Ⅱ×4-Ⅲ可得到在催化剂存在下H2还原NO2生成水蒸气和其它无毒物质的热化学方程式4H2(g)+2NO2(g)=N2(g)+4H2O(g) △H=-1100.2kJmol-1。②根据化学方程式及图示数据,A点时NO2是10mol,O2是10mol,N2是5mol,所以NO2初始物质的量是20mol,则NO2的转化率为50%;B点时NO2和N2物质的量相等,设为xmol,则O2是2xmol,因为容器的总压为a Pa,所以NO2和N2的分压都是![]() a Pa,O2的分压是
a Pa,O2的分压是![]() a Pa,则平衡常数Kp=
a Pa,则平衡常数Kp=![]() =
=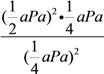 =a Pa。
=a Pa。
(2)①由方程式可看出该反应S<0,因为反应能自发进行,所以H-TS<0,则H<0。②a项,混合气体的平均相对分子质量=气体总质量÷物质的量,该反应的反应物和生成物都是气体,物质的量变化,根据质量守恒定律,所以混合气体的平均相对分子质量变化,则当混合气体的平均相对分子质量保持不变时,达到了平衡状态,故a正确;b项,1molCO2生成同时有3molH-H键断裂,即消耗3molH2,根据化学反应方程式,能说明正逆反应速率相等,则达到了平衡状态,故b正确;c项,开始充入2molCO2和6molH2,投料比等于化学方程式系数比,CO2和H2的转化率始终相等,不能说明正逆反应速率相等,不一定达到平衡状态,故c错误;d项,混合气体的密度等于气体质量和体积的比值,反应前后质量守恒,体积不变,所以密度始终不变,密度保持不变时不一定是平衡状态,故d错误。③由表中数据可知,反应Ⅰ前10min内反应的H2为:(6-4.5)mol=1.5mol,根据化学方程式可得,生成CH3OH为:1.5mol÷3=0.5mol,前10min内的平均反应速率v(CH3OH)=0.5mol÷2L÷10min=0.025 molL-1min-1;前面已知该反应H<0,为放热反应,又因为反应Ⅰ为恒温恒容条件,反应Ⅱ为绝热恒容条件,所以反应Ⅱ相当于升温,化学平衡常数减小,故K(I)>K(II);反应Ⅱ中若把CH3OH和H2O(g)的初始物质的量全部转化为CO2和H2,与反应Ⅰ初始物质的量对应相等,但反应Ⅱ温度高于反应Ⅰ,所以反应Ⅱ相当于在和反应Ⅰ等效的基础上又升高温度,平衡逆向移动,故平衡时CH3OH的浓度c(I)>c(II)。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 碱金属的单质中,锂的还原性最强
B. 第ⅠA族元素比第ⅡA族元素的金属性强
C. 最外层电子数为6的原子都是非金属原子
D. 随着核电荷数的递增,卤素元素的气态氢化物的稳定性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组能够大量共存的是
A. Fe3+、SO42-、NH4+、SCN- B. Fe2+、Cl-、Ba2+、OH-
C. Na+、Mg2+、Cl-、SO42- D. H+、Fe2+、Cl-、NO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物貭的量之向的关系如图所示。则下列説法正确的是( )

A. 溶液中的阳离子一定含有H+、Mg2+、Al3+,可能含有Fe3+
B. 溶液中一定不含CO32-和NO3-,一定含有SO42-
C. 溶液中C(NH4+)=0.2mol/L
D. c(H+):c(Al3+):c(Mg2+)=l:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有以下各组微粒或物质:A.正丁烷和异丁烷;B.金刚石、石墨和C60;C.冰和干冰;D.35Cl和37Cl;E.NO和NO2;其中,互为同分异构体的有__________(填编号,以下同);互为同素异形体的有__________;互为同位素的有__________。
(2)现有:①干冰;②金刚石;③NH4Cl;④Na2S四种物质,按下列要求回答(填序号):熔化时不需要破坏化学键的是____________;既存在离子键又存在共价键的是____________。
(3)向一个容积为2 L的密闭容器中充入7 mol SO2和4 mol O2,在一定温度和压强下,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g),经4 s后达到平衡状态,测得SO2的物质的量是3 mol,则达到平衡状态时O2的转化率为__________;平衡时SO3的物质的量浓度_______。
2SO3(g),经4 s后达到平衡状态,测得SO2的物质的量是3 mol,则达到平衡状态时O2的转化率为__________;平衡时SO3的物质的量浓度_______。
(4)NaBH4(s)与H2O(l)反应生成NaBO2(s)和氢气,在25℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把下列四种盐酸溶液分别加入四个盛有20 mL 1 mol/L的KOH溶液的烧杯中,此时反应最快的是( )
A. 20℃ 20 mL 3 mol/L的盐酸B. 25℃ 30 mL 2 mol/L的盐酸
C. 25℃ 10 mL 5 mol/L的盐酸D. 20℃ 10 mL 2 mol/L的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组模拟工业制漂白粉,设计了下列图的实验装置。已知:①氯气和碱反应放出热量。②6Cl2+6Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O。
5CaCl2+Ca(ClO3)2+6H2O。
回答下列问题:
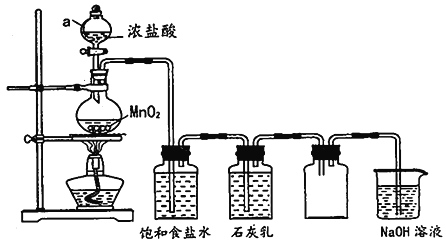
(1)甲装置中仪器a的名称是_____________________。
(2)装置乙中饱和食盐水的作用是_____________________。
(3)①制取漂白粉的化学方程式是______________________________。
②该小组制得的漂白粉中n(CaCl2)远大于n[Ca(ClO)2],则产物中还混杂有物质的化学式是_____。
③为提高Ca(ClO)2的含量,可采取的措施是__________________(任写一种即可)。
(4)漂白粉应密封保存,原因是______________(用化学方程式表示)。
(5)家庭中常用84 消毒液(主要成分NaClO)、洁厕灵(主要成分盐酸)清洁卫生。两者同时混合使用会产生有毒的氯气,写出该反应的离子方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)烷烃A在同温、同压下蒸气的密度是H2的36倍,其分子式为___________。
(2)写出天然橡胶单体(2-甲基-1,3-丁二烯)的结构简式_________。
(3)立方烷![]() 的一氯代物有_________种,它的六氯代物有_________种。
的一氯代物有_________种,它的六氯代物有_________种。
(4)下列物质的沸点按由高到低的顺序排列正确的是___________。
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③ (CH3)3CH ④ (CH3)2CHCH2CH3
A.②④①③ B. ④②①③ C.④③②① D.②④③①
(5)下列选项中互为同系物的是_________;互为同分异构体的是______________;属于同种物质的是_____________。
①H2O和D2O ②1H、2H、3H
③ ④
④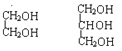
⑤![]() ⑥戊烯和环戊烷 ⑦
⑥戊烯和环戊烷 ⑦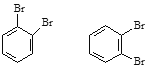
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香草醛是香荚兰豆的香气成分中含有的物质,其结构简式为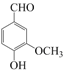 。
。
(1)香草醛含有的含氧官能团有羟基和_______。
(2)香草醛与足量Na2CO3溶液反应的化学方程式为_____________。
(3)香草醛与新制Cu(OH)2反应的化学方程式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com