
【题目】氮氧化物能形成酸雨和光化学烟雾,严重污染环境。燃煤和机动车尾气是氮氧化物的主要来源。现在对其中的一些气体进行了一定的研究:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) △H= 574 kJ·moll
4NO(g)+CO2(g)+2H2O(g) △H= 574 kJ·moll
②CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) △H= 1160 kJ·moll
2N2(g)+CO2(g)+2H2O(g) △H= 1160 kJ·moll
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式______________________________________________________。
(2)在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体。T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,在一定条件下发生反应,反应过程中NO的物质的量随时间变化如图所示。
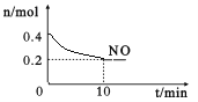
①写出该反应的化学方程式______________________________________。
②10 min内该反应的速率v(CO)=__________________;T℃时,该化学反应的平衡常数K=_______。
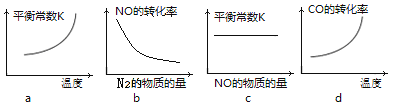
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____________。(填序号)
④一定温度下,在恒容密闭容器中充入一定量NO和CO进行该反应,下列选项能判断反应已达到化学平衡状态的是____________。
a.容器中压强不再变化 b.CO2的浓度不再变化
c.2v正(NO)=v逆(N2) d.气体的密度不再变化
【答案】 CH4(g)+2NO2(g)![]() N2(g)+ CO2(g)+2H2O(g) △H=867 kJ·moll 2NO+2CO
N2(g)+ CO2(g)+2H2O(g) △H=867 kJ·moll 2NO+2CO![]() N2+2CO2 0.010 mol·Ll·minl K=5 bc ab
N2+2CO2 0.010 mol·Ll·minl K=5 bc ab
【解析】(1)由①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJmol-1,②CH4(g)+4NO(g) =2N2(g)+CO2(g)+2H2O(g) △H=-1160kJmol-1,根据盖斯定律, ![]() ×(①+②)可得:CH4(g)+2NO2(g) =N2(g)+CO2(g)+2H2O(g) △H=
×(①+②)可得:CH4(g)+2NO2(g) =N2(g)+CO2(g)+2H2O(g) △H=![]() ×(-574kJmol-1-1160kJmol-1)=-867kJmol-1,故答案为:CH4(g)+2NO2(g)=N2(g)+ CO2(g)+2H2O(g) △H=867 kJ·moll;
×(-574kJmol-1-1160kJmol-1)=-867kJmol-1,故答案为:CH4(g)+2NO2(g)=N2(g)+ CO2(g)+2H2O(g) △H=867 kJ·moll;
(2)①将NO和CO转化成无污染气体参与大气循环,则产生的无污染的气体为N2和CO2,根据图像分析,反应为可逆反应,NO并未完全反应,则该反应的化学方程式为:2NO+2CO![]() N2+2CO2,故答案为:2NO+2CO
N2+2CO2,故答案为:2NO+2CO![]() N2+2CO2;
N2+2CO2;
②10min时,NO的物质的量变化为△n(NO)=0.4mol-0.2mol=0.2mol,容器体积为V=2L,根据化学反应平均速率的公式v(NO)= ![]() =
=![]() =0.01mol/(Lmin),T℃时,反应达到平衡时,容器中各组分的浓度为c(NO)=
=0.01mol/(Lmin),T℃时,反应达到平衡时,容器中各组分的浓度为c(NO)= ![]() =0.1mol/L,c(CO)=
=0.1mol/L,c(CO)= ![]() 0.1mol/L,c(N2)=
0.1mol/L,c(N2)= ![]() =0.05mol/L,c(CO2)=
=0.05mol/L,c(CO2)= ![]() =0.1mol/L,则该化学反应的平衡常数K=
=0.1mol/L,则该化学反应的平衡常数K=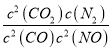 =
= =5L/mol,故答案为:0.005mol/(Lmin);5L/mol;
=5L/mol,故答案为:0.005mol/(Lmin);5L/mol;
③2NO+2CO![]() N2+2CO2 △H<0。a.随着温度升高,反应为放热反应,则化学平衡向逆反应方向移动,平衡常数随温度的升高而减小,故a错误;b.增加N2物质的量,化学平衡向逆反应方向移动,NO的转化率降低,故b正确;c.平衡常数只随温度的改变而改变,改变NO的量不改变化学平衡常数,故c正确;d.随着温度升高,反应为放热反应,则化学平衡向逆反应方向移动,CO的转化率降低,故d错误;故答案为:bc;
N2+2CO2 △H<0。a.随着温度升高,反应为放热反应,则化学平衡向逆反应方向移动,平衡常数随温度的升高而减小,故a错误;b.增加N2物质的量,化学平衡向逆反应方向移动,NO的转化率降低,故b正确;c.平衡常数只随温度的改变而改变,改变NO的量不改变化学平衡常数,故c正确;d.随着温度升高,反应为放热反应,则化学平衡向逆反应方向移动,CO的转化率降低,故d错误;故答案为:bc;
④a.反应为气体子数发生变化的反应,即随着反应进行,压强发生变化,当容器中压强不再变化时,可以判断化学反应是否达到平衡,故a选;b.CO2为生成物,当CO2的浓度不再改变时,可判断化学反应是否达到平衡,故b选;c.2v正(NO)=v逆(N2),化学反应速率之比应为v正(NO)=2v逆(N2),故c不选;d.气体密度为ρ=![]() ,反应前后质量守恒,气体质量m不变,体积为恒容容器,V不变,则化学反应达到平衡前后,气体密度始终不变,不可以判断化学反应是否达到平衡,故d不选;故答案为:ab。
,反应前后质量守恒,气体质量m不变,体积为恒容容器,V不变,则化学反应达到平衡前后,气体密度始终不变,不可以判断化学反应是否达到平衡,故d不选;故答案为:ab。


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3·xH2O、Fe2O3、SiO2等)提取纯Al2O3作冶炼铝的原料,提取时操作过程如图,指出图中操作错误的是( )

A. ④⑤ B. ③④
C. ②⑤ D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相关物质的溶度积常数见下表(25℃):
物质 | Mg(OH)2 | CH3COOAg | AgCl | Ag2CrO4 |
Ksp(单位略) | 1.1×10—11 | 2.3×10﹣3 | 1.8×10﹣10 | 1.9×10﹣12 |
下列有关说法中不正确的是
A. 浓度均为0.2 molL﹣1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀
B. 将0.001 molL﹣1的AgNO3溶液滴入0.001 molL﹣1的KCl和0.001 molL﹣1 的K2CrO4混合溶液中.先产生Ag2CrO4沉淀
C. 0.11 molL﹣1的MgCl2溶液中加入氨水产生Mg(OH)2沉淀时溶液的pH为9
D. 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
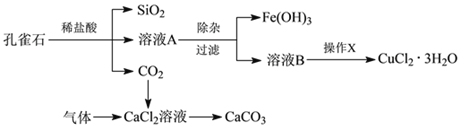
【题目】孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuCl2·3H2O及CaCO3的步骤如下:
为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
物质 | pH (开始沉淀) | pH(完全沉淀) |
Fe(OH)3 | 1.9 | 3.2 |
Fe(OH)2 | 7.0 | 9.0 |
Cu(OH)2 | 4.7 | 6.7 |
(1)在除杂过程时为了除去Fe2+,常加入绿色氧化剂,使Fe2+氧化为Fe3+,此过程涉及的离子方程式为________。
(2)然后再加入适当物质调节溶液的pH至_________ (填写范围),使Fe3+转化为Fe(OH)3,可以达到除去Fe3+,调整溶液pH不可选用下列中的________。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(3)检验Fe(OH)3是否沉淀完全的实验方案是________________________。
(4)操作X包括________、________、过滤和洗涤等。CuCl2·3H2O加热灼烧的最终产物的化学式是 ______________。
(5)某种胃药片的治酸剂为CaCO3,该药片中CaCO3质量分数的测定步骤如下:
a.配制0.1mol·L-1的HCl溶液和0.1mol·L-1的NaOH溶液各250mL。
b.取0.6g磨碎后的胃药于锥形瓶中。
c.向锥形瓶内加入25.00mL 0.1 mol·L-1的HCl溶液。
d.以酚酞为指示剂,用0.1mol·L-1的NaOH溶液滴定,至达到滴定终点。
e.重复bcd三步的操作2次。
①读数时,若滴定前平视,滴定后仰视,则所测CaCO3的质量分数将________(选填“偏大”、“偏小”或“无影响”)。
②若滴定中NaOH溶液的平均用量为15.00mL,则胃药中碳酸钙的质量分数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为1mol甲烧在足量的氧气中燃烧生成CO2(g)和H2O(g)时的能量变化示意图,由此图分析得出的下列结论中错误的是()

A. 该反应中反应物的总能量高于生成物的总能量
B. 甲烷的燃烧热△H =-802kJ mol-1
C. 该反应的活化能为213kJ mol-1
D. 该反应的热化学方程式为CH4(g)+202(g)=CO2(g)+2H2O(g) △H =-802kJ mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素在元素周期表中的位置为____________________
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 __________________
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4,反应生成N2和水蒸气。
已知①N2(g)=N2O4(l) △H1=-19.5kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) △H2=-534.2kJ·mol-1
肼和N2O4反应的热化学方程式为___________________________
(4)“长征“火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,既能在短时间内产生巨大能量,产物又不污染空气( 产物都是空气成分)。将此原理设计为原电池,如下图所示,据此回答问题:

①B为___________极,从d口排出的气体是____________ 。
②A极发生的电极反应式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容容器中,发生反应:2A(g)+B(s) ![]() C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( )
C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( )
①混合气体的密度不变
②混合气体的压强不变
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2:1:1
⑤单位时间内生成n mol C,同时生成n mol D
⑥单位时间内生成n mol D,同时生成2n mol A
A. ①③⑤ B. ②③④ C. ①③⑥ D. ②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是A~F物质间的相互转化关系图。已知A~F中均含有一种相同的元素,B是一种工业产品,应用广泛,D在常温下是气体。C是单质,很脆的淡黄色晶体。C与F物质的量之比1∶1反应生成A。
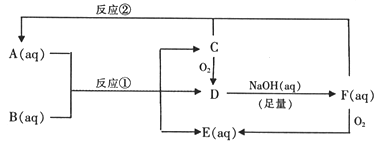
请回答:
(1)A的化学式________。
(2)反应①的离子方程式________。
(3)将C与过量浓NaOH溶液混合加热,有F生成。写出反应的化学方程式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com