
【题目】下图为1mol甲烧在足量的氧气中燃烧生成CO2(g)和H2O(g)时的能量变化示意图,由此图分析得出的下列结论中错误的是()

A. 该反应中反应物的总能量高于生成物的总能量
B. 甲烷的燃烧热△H =-802kJ mol-1
C. 该反应的活化能为213kJ mol-1
D. 该反应的热化学方程式为CH4(g)+202(g)=CO2(g)+2H2O(g) △H =-802kJ mol-1
科目:高中化学 来源: 题型:
【题目】电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(1)25 ℃时,等浓度的三种溶液(a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液)的pH由大到小的顺序为________________________________。(填写序号)
(2)25 ℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_____________________。
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是 _______。
A.c(H+)>c(OH-) B. c(H+)<c(OH-)
C.c(H+)+c(HCN) = C(OH-) D.c(HCN)+c(CN-)=0.01mol/L
(4)常温下,将某一元酸HA 和NaOH 溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH 如下表:
实验编号 | HA物质的量浓度(molL-1) | NaOH物质的量浓度(molL-1) | 混合溶液的pH |
a | 0.1 | 0.1 | pH=9 |
b | c | 0.2 | pH=7 |
请回答:
①从a组情况分析, HA是强酸还是弱酸_____________。
②b组情况表明,c_______0.2(选填“大于”“小于”或“等于”)。混合溶液中离子浓度c(A-)________ c(Na+)(选填“大于”“小于”或“等于”)。
③a组实验所得混合溶液中由水电离出的c(OH-)=______molL-1.写出该混合溶液中下列算式的精确结果(不需做近似计算).c(Na+)-c(A-)=______molL-1 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺(CH3NH2) 的性质与氨相似。25℃时,向10mL1.0000mol·L-1甲胺溶液中滴入0.5000mol·L-1的稀硫酸,溶液的pOH 与所加稀硫酸的体积(V)关系如图所示。
已知:pOH=-lgc(OH-),Kb(CH3NH2·H2O)=4.0×10-4。下列说法正确的是( )
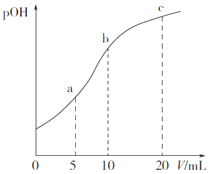
A. pOH=7 时,2c(CH3NH3+)=c(SO42-)
B. 水的电离程度:c>b>a
C. a点溶液中存在:c(CH3NH2·H2O)>c(CH3NH3+)>c(H+)>c(OH-)
D. 25℃时1.000 mol·L-1甲胺溶液中CH3NH2·H2O的电离度约为2.0%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
选项 | A | B | C | D |
实验 | 用CCl4提取溴水中的Br2 | 从食盐水中提取NaCl固体 | 从KI和I2的固体混合物中回收I2 | 配制100 mL 0.100 0 mol·L-1 K2Cr2O7溶液 |
装置或仪器 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp (CaCO3)=2.8×10-9 Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是
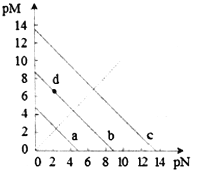
A. a线是CaSO4沉定溶解平衡曲线
B. T℃时,向10mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+)∶c(Pb2+)=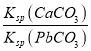
C. d点表示CaCO3的饱和溶液。且c(Ca2+)<c(CO32-)
D. T℃时,向CaSO4沉淀中加入1mol·L-1的Na2CO3溶液,CaSO4沉淀会转化为CaCO3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物能形成酸雨和光化学烟雾,严重污染环境。燃煤和机动车尾气是氮氧化物的主要来源。现在对其中的一些气体进行了一定的研究:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) △H= 574 kJ·moll
4NO(g)+CO2(g)+2H2O(g) △H= 574 kJ·moll
②CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) △H= 1160 kJ·moll
2N2(g)+CO2(g)+2H2O(g) △H= 1160 kJ·moll
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式______________________________________________________。
(2)在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体。T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,在一定条件下发生反应,反应过程中NO的物质的量随时间变化如图所示。
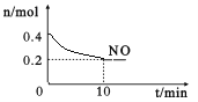
①写出该反应的化学方程式______________________________________。
②10 min内该反应的速率v(CO)=__________________;T℃时,该化学反应的平衡常数K=_______。
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____________。(填序号)
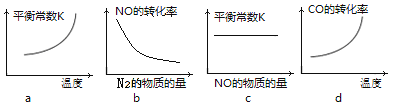
④一定温度下,在恒容密闭容器中充入一定量NO和CO进行该反应,下列选项能判断反应已达到化学平衡状态的是____________。
a.容器中压强不再变化 b.CO2的浓度不再变化
c.2v正(NO)=v逆(N2) d.气体的密度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图甲和乙是双液原电池装置,据图判断下列说法错误的是( )
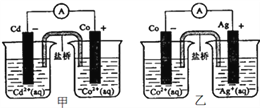
A. 盐桥的作用是形成闭合回路,并使两边溶液保持电中性
B. 甲图,电池反应的离子方程式为: Cd(s)+Co2+(aq)=Co(s)+Cd2+(aq)
C. 乙图,当有1mol电子通过外电路时,正极有108gAg析出
D. 反应: 2Ag(s)+Cd2+(aq)=Cd(s)+2Ag+(aq)能够发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2![]() O2+HbCO,37℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。下列结论错误的是( )
O2+HbCO,37℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。下列结论错误的是( )
A. CO与HbO2反应的平衡常数K=![]()
B. 当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
C. 人体吸入的CO越多,与血红蛋白结合的O2越少
D. 把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO3溶液显酸性,还原性:HSO3->I-,氧化性:IO3->I2。在含3mol NaHSO3的溶液中逐滴加入NaIO3溶液。加入NaIO3的物质的量和析出的I2的物质的量的关系曲线如图。下列说法正确的是 ( )
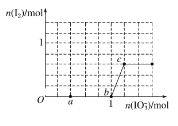
A. 反应过程中的氧化产物均为Na2SO4
B. a点时消耗NaHSO3的物质的量为1.0 mol
C. O~b间的反应可用如下离子方程式表示:3HSO3-+IO3-+3OH-===3SO42-+I-+3H2O
D. 当溶液中I-与I2的物质的量之比为5∶3时,加入的NaIO3为1.1 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com