
【题目】下图甲和乙是双液原电池装置,据图判断下列说法错误的是( )
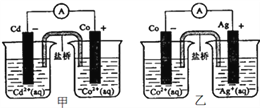
A. 盐桥的作用是形成闭合回路,并使两边溶液保持电中性
B. 甲图,电池反应的离子方程式为: Cd(s)+Co2+(aq)=Co(s)+Cd2+(aq)
C. 乙图,当有1mol电子通过外电路时,正极有108gAg析出
D. 反应: 2Ag(s)+Cd2+(aq)=Cd(s)+2Ag+(aq)能够发生
【答案】D
【解析】A.原电池放电时,盐桥中的阴阳离子定向移动而构成闭合回路,且使两溶液中电荷相等,所以盐桥的作用是形成闭合回路,并使两边溶液保持电中性,选项A正确;B.根据原电池甲可知,Cd为负极,失电子,Co2+得电子,所以其电池反应离子方程式为Cd(s)+Co2+(aq)=Co(s)+Cd2+(aq),金属活动性Cd>Co,选项B正确;C.根据Co(s)+2Ag +(aq)=2Ag(s)+Co2+(aq)知,当有lmol电子通过外电路时,正极有108g Ag析出,选项C正确;D.根据原电池乙可知,Co失电子,Ag + 得电子,所以Co(s)+2Ag +(aq)=2Ag(s)+Co2+(aq),金属活动性Co>Ag,则有金属活动性:Cd>Co>Ag,因此2Ag(s)+ Cd2+(aq) = Cd(s) +2Ag+(aq)反应不能发生,选项D错误。答案选D。


科目:高中化学 来源: 题型:
【题目】软锰矿的主要成分是MnO2,其悬浊液可吸收烟气中SO2,所得酸性浸出液又可用于制备高纯硫酸锰,其一种工艺流程如图所示。回答下列问题:

(1)软锰矿悬浊液吸收SO2的过程中,SO2体现了________性。
(2)“氧化剂”发生反应的离子方程式为____________。
(3)已知:Ksp[Al(OH) 3]=1.0×10-34;
Krp[Fe(OH) 3]=2.6×10-30;
Krp[Ni(OH) 2]=1.6×10-15;
Krp[Mn(OH) 2]=4.0×10-14;
“水解沉淀“中:
①“中和剂“可以是________(填标号)
A.Al2O3 B.H2SO4 C.MgO D.MnO2
②溶液的pH应不低于________(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全)
③不采用“水解沉淀“除Ni2+的原因是___________。
(4)“置换”中发生反应的离子方程式为____________。
(5)“结品分离”中的部分物质的溶解度曲线如图。

①加入稀硫酸的作用是(结合平衡移动原理解释)_____________。
②结晶与过滤过程中,体系温度均应维持在_______℃(填“27”、“60”或“70”)。
(6)高纯硫酸锰可用于水中溶解氧含量的测定,步骤如下:
步骤1:水中的氧气在碱性溶液中将MnSO4氧化为MnO(OH)2。
步骤2:在酸性条件下,加入KI将生成的MnO(OH)2再还原成Mn2+。
步骤3:用Na2S2O3标准溶液滴定步骤2中生成的I2(2S2O32-+I2=2I-+S4O62-)。
取某水样100mL,按上述测定步骤滴定,消耗a mol·L-1 NaS2O3标准溶液VmL,该水样溶解氧含量为
_________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组在相同条件下,将10.00g下列物质分别置于相同规格的烧杯,并敞口存放于空气中,烧杯中物质质量随时间变化如下表,回答下列问题。

(1)下列图示能反映水在空气中放置时发生变化的微观示意图是_________(填字母序号)。
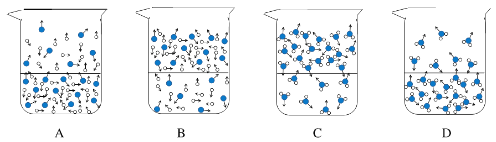
图中![]() 表示氧原子,
表示氧原子,![]() 表示氢原子)
表示氢原子)
(2)石灰水在空气中久置后有浑浊现象,写出该反应的化学方程式___________________。
(3)为研制一种安全、环保的除湿剂,可选择上表中的__________________(填溶质的化学式)。
(4)将10.00g氯化钠浓溶液敞口久置后,最终得到2.26g晶体(已知该温度下氯化钠溶解度为36.1g),则该溶液是________(填“饱和”或“不饱和”)溶液。
(5)为进一步研究稀盐酸敞口久置后浓度变化,该小组开展如下探究。
①甲同学猜想浓度可能会变大,理由是_______________________。
②为验证甲同学的猜想是否正确,设计实验方案:_________________________。
(6)乙同学取20%的氢氧化钠溶液20.00g,敞口放置一段时间后部分变质,得到18.80g溶液,_________(填“能”或“不能”)计算所得溶液中溶质组成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为1mol甲烧在足量的氧气中燃烧生成CO2(g)和H2O(g)时的能量变化示意图,由此图分析得出的下列结论中错误的是()

A. 该反应中反应物的总能量高于生成物的总能量
B. 甲烷的燃烧热△H =-802kJ mol-1
C. 该反应的活化能为213kJ mol-1
D. 该反应的热化学方程式为CH4(g)+202(g)=CO2(g)+2H2O(g) △H =-802kJ mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 氯化铵溶液,加水稀释时,c(NH4+)/c(Cl-)的值一定减小
B. 0.1 mol·L-1的盐酸和0.1 mol·L-1的弱酸HA溶液分别加水稀释10倍:pH(HA) > pH(盐酸)
C. 已知25℃时,HA的Ka=6.25×10—5,当pH为5.0时,HA溶液中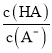 = 0.16
= 0.16
D. 某二元酸的酸式盐NaHA溶液中必然存在:c(H+)+c(A2—)=c(OH—)+c(H2A)
【答案】D
【解析】A、加水稀释时,促进铵根离子水解,所以铵根离子浓度减小的程度大,c(NH4+)/c(Cl-)的值一定减小,选项A正确;B、0.1 mol·L-1的盐酸(pH=1)和0.1 mol·L-1的弱酸HA(pH>1)溶液分别加水稀释10倍后,盐酸的pH=2,HA的pH>2,pH(HA) > pH(盐酸),选项B正确;C、根据HA![]() H++A-,Ka=
H++A-,Ka=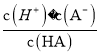 =6.25×10-5,故当溶液的pH为5.0时,c(H+)=10-5 mol·L-1,HA溶液中
=6.25×10-5,故当溶液的pH为5.0时,c(H+)=10-5 mol·L-1,HA溶液中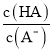 =
=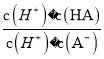 =
=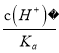 =
=![]() =0.16,选项C正确;D、依据溶液中电荷守恒和物料守恒计算分析,某二元弱酸的酸式盐NaHA溶液中电荷守恒c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-),物料守恒c(Na+)=c(H2A)+c(HA-)+c(A2-),计算得到c(OH-)+c(A2-)=c(H+)+c(H2A),选项D错误。答案选D。
=0.16,选项C正确;D、依据溶液中电荷守恒和物料守恒计算分析,某二元弱酸的酸式盐NaHA溶液中电荷守恒c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-),物料守恒c(Na+)=c(H2A)+c(HA-)+c(A2-),计算得到c(OH-)+c(A2-)=c(H+)+c(H2A),选项D错误。答案选D。
【题型】单选题
【结束】
24
【题目】有关锌-稀硫酸-铜构成的原电池的一些说法中,正确的是( )
A. 锌片为正极,且锌片逐渐溶解
B. 铜片为负极,且铜片上有气泡
C. 溶液中的H+移向铜极
D. 该电池工作的过程中溶液的酸性始终不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素在元素周期表中的位置为____________________
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 __________________
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4,反应生成N2和水蒸气。
已知①N2(g)=N2O4(l) △H1=-19.5kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) △H2=-534.2kJ·mol-1
肼和N2O4反应的热化学方程式为___________________________
(4)“长征“火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,既能在短时间内产生巨大能量,产物又不污染空气( 产物都是空气成分)。将此原理设计为原电池,如下图所示,据此回答问题:

①B为___________极,从d口排出的气体是____________ 。
②A极发生的电极反应式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲、乙两个容积均为1 L的恒容容器中。现向甲中充入2 mol A、2 mol B,乙中充入1 mol A、1 mol B。相同温度下发生反应:A(g)+B(g) ![]() xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是 ( )
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是 ( )


A. x不可能等于1
B. 甲、乙两容器中反应达平衡时,平衡常数K甲<K乙
C. 将乙容器升温可使甲、乙容器内各物质的体积分数相同
D. 若向甲容器中再充入2 mol A、2 mol B,则平衡时甲中0.78 mol·L-1<c(A)<1.56 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表中所列键能数据,判断下列分子中,最不稳定的分子是( )
化学键 | H—H | H—Cl | H—I | Cl—Cl | Br—Br |
键能/kJ/mol | 436 | 431 | 299 | 247 | 193 |
A.HClB.HBrC.H2D.Br2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com