
【题目】某兴趣小组在相同条件下,将10.00g下列物质分别置于相同规格的烧杯,并敞口存放于空气中,烧杯中物质质量随时间变化如下表,回答下列问题。

(1)下列图示能反映水在空气中放置时发生变化的微观示意图是_________(填字母序号)。
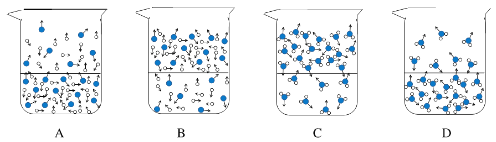
图中![]() 表示氧原子,
表示氧原子,![]() 表示氢原子)
表示氢原子)
(2)石灰水在空气中久置后有浑浊现象,写出该反应的化学方程式___________________。
(3)为研制一种安全、环保的除湿剂,可选择上表中的__________________(填溶质的化学式)。
(4)将10.00g氯化钠浓溶液敞口久置后,最终得到2.26g晶体(已知该温度下氯化钠溶解度为36.1g),则该溶液是________(填“饱和”或“不饱和”)溶液。
(5)为进一步研究稀盐酸敞口久置后浓度变化,该小组开展如下探究。
①甲同学猜想浓度可能会变大,理由是_______________________。
②为验证甲同学的猜想是否正确,设计实验方案:_________________________。
(6)乙同学取20%的氢氧化钠溶液20.00g,敞口放置一段时间后部分变质,得到18.80g溶液,_________(填“能”或“不能”)计算所得溶液中溶质组成。
【答案】DCa(OH)2+CO2=CaCO3↓+ H2OCaCl2不饱和稀盐酸中水的蒸发量大于HCl的挥发量取等质量的原盐酸和久置的盐酸,均加酚酞溶液,分别滴入等浓度的NaOH溶液,至溶液由无色变红色时,比较消耗氢氧化钠的量不能
【解析】
(1)水放置在空气中时表面的水分子会扩散到空气中,且液面上单位体积的水分子数小于液面下的水分子数,故选D;(2)石灰水在空气中久置后有浑浊现象是由于氢氧化钙与空气中的二氧化碳反应生成碳酸钙沉淀和水,反应方程式为Ca(OH)2+CO2=CaCO3↓ + H2O;(3)氯化钙溶液和浓硫酸溶液的质量增加,但是浓硫酸有强烈的腐蚀性,故选氯化钙;(4)该温度下氯化钠溶解度为36.1g,则该温度下10g的水中最多能溶解氯化钠的质量为3.61g,故该溶液是不饱和溶液;(5)①甲同学猜想浓度可能会变大,理由是稀盐酸敞口放置后有水分蒸发,故答案为:稀盐酸中水的蒸发量大于HCl的挥发量;②为验证甲同学的猜想是否正确,设计实验方案:取等质量的原盐酸和久置的盐酸,均加酚酞溶液,分别滴入等浓度的NaOH溶液,至溶液由无色变红色时,比较消耗氢氧化钠的量;(6)氢氧化钠溶液敞口放置一段时间后部分发生了变质,溶质为NaOH和Na2CO3两种物质,不能计算出溶质的组成,故答案为:不能。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如右图所示。据图判断正确的是
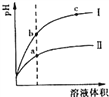
A. Ⅱ为盐酸稀释时的pH值变化曲线
B. b点溶液的导电性比c点溶液的导电性强
C. a点KW的数值比c点KW的数值大
D. b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺(CH3NH2) 的性质与氨相似。25℃时,向10mL1.0000mol·L-1甲胺溶液中滴入0.5000mol·L-1的稀硫酸,溶液的pOH 与所加稀硫酸的体积(V)关系如图所示。
已知:pOH=-lgc(OH-),Kb(CH3NH2·H2O)=4.0×10-4。下列说法正确的是( )
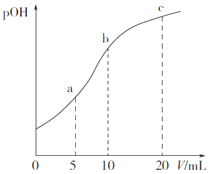
A. pOH=7 时,2c(CH3NH3+)=c(SO42-)
B. 水的电离程度:c>b>a
C. a点溶液中存在:c(CH3NH2·H2O)>c(CH3NH3+)>c(H+)>c(OH-)
D. 25℃时1.000 mol·L-1甲胺溶液中CH3NH2·H2O的电离度约为2.0%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为—285.8kJ·mol-1、—283.0kJ·mol-1和—726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_______________________________________________________;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考查温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
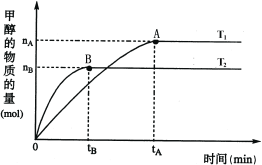
下列说法正确的是________(填序号)
a.温度为T1时,从反应开始到平衡,生成甲醇的平均速率为:v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
b.T1> T2
c.该反应为放热反应
d.处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
(4)在T1温度时,将1molCO2和3molH2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为α, 则容器内的压强与起始压强之比为_______________________;
(5)在直接以甲醇为燃料的电池中,电解质溶液为碱性,负极的反应式为________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
选项 | A | B | C | D |
实验 | 用CCl4提取溴水中的Br2 | 从食盐水中提取NaCl固体 | 从KI和I2的固体混合物中回收I2 | 配制100 mL 0.100 0 mol·L-1 K2Cr2O7溶液 |
装置或仪器 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp (CaCO3)=2.8×10-9 Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是
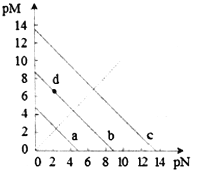
A. a线是CaSO4沉定溶解平衡曲线
B. T℃时,向10mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+)∶c(Pb2+)=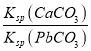
C. d点表示CaCO3的饱和溶液。且c(Ca2+)<c(CO32-)
D. T℃时,向CaSO4沉淀中加入1mol·L-1的Na2CO3溶液,CaSO4沉淀会转化为CaCO3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图甲和乙是双液原电池装置,据图判断下列说法错误的是( )
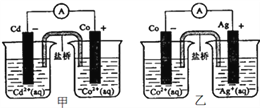
A. 盐桥的作用是形成闭合回路,并使两边溶液保持电中性
B. 甲图,电池反应的离子方程式为: Cd(s)+Co2+(aq)=Co(s)+Cd2+(aq)
C. 乙图,当有1mol电子通过外电路时,正极有108gAg析出
D. 反应: 2Ag(s)+Cd2+(aq)=Cd(s)+2Ag+(aq)能够发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有Ba(NO3)2、AgNO3、Fe(NO3)3的混合液,欲将Ba2+、Ag+、Fe3+分离,分别得到三种元素的不溶物,按如图所示实验:

(1)加入的试剂(写化学式):X________,Y________,Z________。
生成的沉淀(写化学式):A________,B________,C________。
(2)写出反应①②③的离子方程式:
①_____________________________________________________________,
②_____________________________________________________________,
③_____________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com