
【题目】已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp (CaCO3)=2.8×10-9 Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是
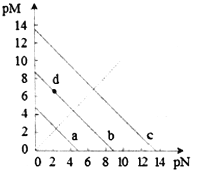
A. a线是CaSO4沉定溶解平衡曲线
B. T℃时,向10mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+)∶c(Pb2+)=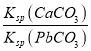
C. d点表示CaCO3的饱和溶液。且c(Ca2+)<c(CO32-)
D. T℃时,向CaSO4沉淀中加入1mol·L-1的Na2CO3溶液,CaSO4沉淀会转化为CaCO3沉淀
【答案】C
【解析】A. 由Ksp(CaSO4)=4.90×10-5得c(Ca2+)c(SO42-)=4.90×10-5,两边取负对数得:-lgc(Ca2+)- lgc(SO42-)=5-lg4.9,曲线在pN轴和pM轴上截距相等为5-lg4.9,与图中最接近的曲线为a,所以A正确;B. 在二者饱和溶液中,Ksp(CaCO)与Ksp(PbCO3)在计算中使用相同的c(CO32-),所以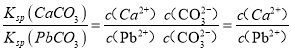 ,所以B正确;C. 由A知曲线b为Ksp (CaCO3)=2.8×10-9曲线,d点表示CaCO3的饱和溶液。且c(Ca2+)>c(CO32-),所以C错误;D. 因为Ksp (CaCO3) < Ksp(CaSO4),所以当CaSO4沉淀中加入1mol·L-1的Na2CO3溶液后,Qc> Ksp (CaCO3),则CaSO4沉淀逐渐溶解,CaCO3沉淀逐渐生成,所以D正确,故选择C。
,所以B正确;C. 由A知曲线b为Ksp (CaCO3)=2.8×10-9曲线,d点表示CaCO3的饱和溶液。且c(Ca2+)>c(CO32-),所以C错误;D. 因为Ksp (CaCO3) < Ksp(CaSO4),所以当CaSO4沉淀中加入1mol·L-1的Na2CO3溶液后,Qc> Ksp (CaCO3),则CaSO4沉淀逐渐溶解,CaCO3沉淀逐渐生成,所以D正确,故选择C。


科目:高中化学 来源: 题型:
【题目】2011年,麻省理工学院科研团队研发出一种人造树叶,它将一片半导体材料夹在两层特殊的催化剂的中间。若将人造树叶整体浸泡在溶液中,当光照在人造树叶上,就会分解水生成H2和O2,结构如图所示。下列有关人造树叶说法正确的是

A. 该装置最终将太阳能转变为电能
B. Ni、Mo、Zn基催化剂极为阳极,发生氧化反应
C. 可以将人造树叶浸泡在碱性溶液中
D. 钴基催化剂上发生反应:2H2O-4e-=4H++O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组在相同条件下,将10.00g下列物质分别置于相同规格的烧杯,并敞口存放于空气中,烧杯中物质质量随时间变化如下表,回答下列问题。

(1)下列图示能反映水在空气中放置时发生变化的微观示意图是_________(填字母序号)。
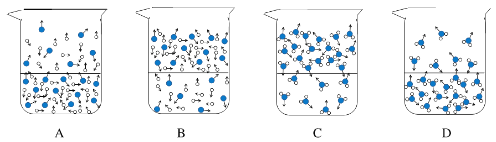
图中![]() 表示氧原子,
表示氧原子,![]() 表示氢原子)
表示氢原子)
(2)石灰水在空气中久置后有浑浊现象,写出该反应的化学方程式___________________。
(3)为研制一种安全、环保的除湿剂,可选择上表中的__________________(填溶质的化学式)。
(4)将10.00g氯化钠浓溶液敞口久置后,最终得到2.26g晶体(已知该温度下氯化钠溶解度为36.1g),则该溶液是________(填“饱和”或“不饱和”)溶液。
(5)为进一步研究稀盐酸敞口久置后浓度变化,该小组开展如下探究。
①甲同学猜想浓度可能会变大,理由是_______________________。
②为验证甲同学的猜想是否正确,设计实验方案:_________________________。
(6)乙同学取20%的氢氧化钠溶液20.00g,敞口放置一段时间后部分变质,得到18.80g溶液,_________(填“能”或“不能”)计算所得溶液中溶质组成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两个连通容器用活塞分开,左右两室体积相同,左室充入一定里NO,右室充入一定量O2,且恰好使两容器内气体密度相同。打开活塞,使NO与O2充分反应,下列判断正确的是(不考虑NO2转化为N2O4) ( )
![]()
A.反应前后左室的压强相同
B.开始时左右两室中的分子数相同
C.反应后容器内的密度与反应前的相同
D.反应后容器内无O2存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为1mol甲烧在足量的氧气中燃烧生成CO2(g)和H2O(g)时的能量变化示意图,由此图分析得出的下列结论中错误的是()

A. 该反应中反应物的总能量高于生成物的总能量
B. 甲烷的燃烧热△H =-802kJ mol-1
C. 该反应的活化能为213kJ mol-1
D. 该反应的热化学方程式为CH4(g)+202(g)=CO2(g)+2H2O(g) △H =-802kJ mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 氯化铵溶液,加水稀释时,c(NH4+)/c(Cl-)的值一定减小
B. 0.1 mol·L-1的盐酸和0.1 mol·L-1的弱酸HA溶液分别加水稀释10倍:pH(HA) > pH(盐酸)
C. 已知25℃时,HA的Ka=6.25×10—5,当pH为5.0时,HA溶液中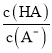 = 0.16
= 0.16
D. 某二元酸的酸式盐NaHA溶液中必然存在:c(H+)+c(A2—)=c(OH—)+c(H2A)
【答案】D
【解析】A、加水稀释时,促进铵根离子水解,所以铵根离子浓度减小的程度大,c(NH4+)/c(Cl-)的值一定减小,选项A正确;B、0.1 mol·L-1的盐酸(pH=1)和0.1 mol·L-1的弱酸HA(pH>1)溶液分别加水稀释10倍后,盐酸的pH=2,HA的pH>2,pH(HA) > pH(盐酸),选项B正确;C、根据HA![]() H++A-,Ka=
H++A-,Ka=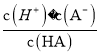 =6.25×10-5,故当溶液的pH为5.0时,c(H+)=10-5 mol·L-1,HA溶液中
=6.25×10-5,故当溶液的pH为5.0时,c(H+)=10-5 mol·L-1,HA溶液中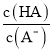 =
=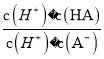 =
=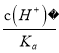 =
=![]() =0.16,选项C正确;D、依据溶液中电荷守恒和物料守恒计算分析,某二元弱酸的酸式盐NaHA溶液中电荷守恒c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-),物料守恒c(Na+)=c(H2A)+c(HA-)+c(A2-),计算得到c(OH-)+c(A2-)=c(H+)+c(H2A),选项D错误。答案选D。
=0.16,选项C正确;D、依据溶液中电荷守恒和物料守恒计算分析,某二元弱酸的酸式盐NaHA溶液中电荷守恒c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-),物料守恒c(Na+)=c(H2A)+c(HA-)+c(A2-),计算得到c(OH-)+c(A2-)=c(H+)+c(H2A),选项D错误。答案选D。
【题型】单选题
【结束】
24
【题目】有关锌-稀硫酸-铜构成的原电池的一些说法中,正确的是( )
A. 锌片为正极,且锌片逐渐溶解
B. 铜片为负极,且铜片上有气泡
C. 溶液中的H+移向铜极
D. 该电池工作的过程中溶液的酸性始终不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)![]() 2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
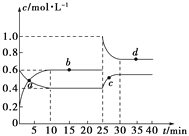
(1)该温度下,该反应的平衡常数为___________,若温度升高,K值将________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的是________点。从起点开始首次达到平衡时,以NO2表示的反应速率为________。
(3)25 min时,加入了________(填加入物质的化学式及加入的物质的量),使平衡发生了移动。
(4)d点对应NO2的物质的量浓度_______(填“大于”、“小于”或“等于”)0.8 mol·L-1,理由是__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com