
����Ŀ���ں��º��������£���һ����NO2��N2O4�Ļ������ͨ���ݻ�Ϊ2 L���ܱ������з�����Ӧ��N2O4(g)![]() 2NO2(g)����H>0����Ӧ�����и����ʵ����ʵ���Ũ��(c)��ʱ��(t)�ı仯������ͼ��ʾ��
2NO2(g)����H>0����Ӧ�����и����ʵ����ʵ���Ũ��(c)��ʱ��(t)�ı仯������ͼ��ʾ��
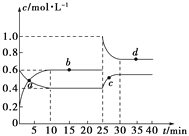
(1)���¶��£��÷�Ӧ��ƽ�ⳣ��Ϊ___________�����¶����ߣ�Kֵ��________(����������������С������������)��
(2)a��b��c��d�ĸ����У���ʾ��ѧ��Ӧ����ƽ��״̬����________�㡣����㿪ʼ�״δﵽƽ��ʱ����NO2��ʾ�ķ�Ӧ����Ϊ________��
(3)25 minʱ��������________(��������ʵĻ�ѧʽ����������ʵ���)��ʹƽ�ⷢ�����ƶ���
(4)d���ӦNO2�����ʵ���Ũ��_______(��������������С��������������)0.8 mol��L��1��������__________________________________________��
���𰸡� 0.9 ���� bd 0.04 mol��L��1��min��1 0.8 mol NO2 С�� ����ƽ��ʱ����������Ũ��Ϊ0.8 mol��L��1�����ʱQ��1.28>K��0.9��ƽ��Ҫ�����ƶ���ʹ����������Ũ�Ƚ��ͣ�����ƽ��ʱ����������Ũ��С��0.8 mol��L��1
����������1������ͼ����Ϣ��֪10minʱ��ƽ�⣬ƽ��ʱc(N2O4)=0.4mol/L��c(NO2)=0.6mol/L����K=![]() =0.9mol/L���÷�ӦΪ���ȷ�Ӧ�������¶����ߣ�Kֵ����2����ͼ��֪10-25minƽ��״̬ʱ��X��ʾ���������Ũ�ȱ仯��Ϊ��0.6-0.2��mol/L=0.4mol/L��Y��ʾ�ķ�Ӧ���Ũ�ȱ仯��Ϊ��0.6-0.4��mol/L=0.2mol/L��X��ʾ���������Ũ�ȱ仯����Y��ʾ�ķ�Ӧ���Ũ�ȱ仯����2��������X��ʾNO2Ũ����ʱ��ı仯���ߣ�Y��ʾN2O4Ũ����ʱ��ı仯���ߣ�����㿪ʼ�״δﵽƽ��ʱ����NO2��ʾ�ķ�Ӧ����Ϊ
=0.9mol/L���÷�ӦΪ���ȷ�Ӧ�������¶����ߣ�Kֵ����2����ͼ��֪10-25minƽ��״̬ʱ��X��ʾ���������Ũ�ȱ仯��Ϊ��0.6-0.2��mol/L=0.4mol/L��Y��ʾ�ķ�Ӧ���Ũ�ȱ仯��Ϊ��0.6-0.4��mol/L=0.2mol/L��X��ʾ���������Ũ�ȱ仯����Y��ʾ�ķ�Ӧ���Ũ�ȱ仯����2��������X��ʾNO2Ũ����ʱ��ı仯���ߣ�Y��ʾN2O4Ũ����ʱ��ı仯���ߣ�����㿪ʼ�״δﵽƽ��ʱ����NO2��ʾ�ķ�Ӧ����Ϊ![]() =0.04 mol��L��1��min��1����ͼ��֪��10-25min��35min֮��X��Y�����ʵ����������仯������Ӧʱ����ڵĵ㴦�ڻ�ѧƽ��״̬����b��d���ڻ�ѧƽ��״̬����3��25minʱ��c��NO2��˲������ƽ��״̬�����ˣ�1-0.6����2=0.8mol ����c��NO2����ƽ��������N2O4�����ƶ�����4����ƽ��ʱ����������Ũ��Ϊ0.8 mol��L��1�����ʱQ��1.28>K��0.9��ƽ��Ҫ�����ƶ���ʹ����������Ũ�Ƚ��ͣ�����ƽ��ʱ����������Ũ��С��0.8 mol��L��1 ��
=0.04 mol��L��1��min��1����ͼ��֪��10-25min��35min֮��X��Y�����ʵ����������仯������Ӧʱ����ڵĵ㴦�ڻ�ѧƽ��״̬����b��d���ڻ�ѧƽ��״̬����3��25minʱ��c��NO2��˲������ƽ��״̬�����ˣ�1-0.6����2=0.8mol ����c��NO2����ƽ��������N2O4�����ƶ�����4����ƽ��ʱ����������Ũ��Ϊ0.8 mol��L��1�����ʱQ��1.28>K��0.9��ƽ��Ҫ�����ƶ���ʹ����������Ũ�Ƚ��ͣ�����ƽ��ʱ����������Ũ��С��0.8 mol��L��1 ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��T��ʱ��Ksp(CaSO4)=4.90��10-5��Ksp (CaCO3)=2.8��10-9 Ksp(PbCO3)=8.4��10-14�������εij����ܽ�ƽ��������ͼ��ʾ��pM=-lgc������������pN=-lgc����������������˵���������
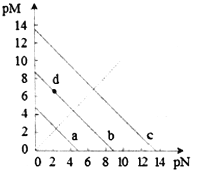
A. a����CaSO4�����ܽ�ƽ������
B. T��ʱ����10mLˮ�м���CaCO3��PbCO3�����߾����ͣ���Һ��c(Ca2+)��c(Pb2+)=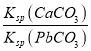
C. d���ʾCaCO3�ı�����Һ����c(Ca2+)<c(CO32-)
D. T��ʱ����CaSO4�����м���1mol��L-1��Na2CO3��Һ��CaSO4������ת��ΪCaCO3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ������������ԭ�����͵��ǣ� ��
A. ��ɫʯ����Һ�����Ϊ��ɫ
B. ʹ������ý���ɼӿ�ϳɰ���Ӧ����
C. �ϳɰ���ҵ����500��ĸ��½�������
D. һ��������2HI(g) ![]() H2(g)+I2(g)��ƽ���ѹ����ϵ����������ɫѸ�ٱ���
H2(g)+I2(g)��ƽ���ѹ����ϵ����������ɫѸ�ٱ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ba(NO3)2��AgNO3��Fe(NO3)3�Ļ��Һ������Ba2����Ag����Fe3�����룬�ֱ�õ�����Ԫ�صIJ��������ͼ��ʾʵ�飺

(1)������Լ�(д��ѧʽ)��X________��Y________��Z________��
���ɵij���(д��ѧʽ)��A________��B________��C________��
(2)д����Ӧ�٢ڢ۵����ӷ���ʽ��
��_____________________________________________________________��
��_____________________________________________________________��
��_____________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ѪҺ���鵥�С������ǡ�һ��Ľ��Ϊ4.94��10��3 molL��1 �� ����ġ�4.94��10��3 molL��1����ʾ�����ǵģ� ��
A.���ʵ���
B.Ħ������
C.��������
D.���ʵ���Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪NaHSO3��Һ�����ԣ���ԭ�ԣ�HSO3����I���������ԣ�IO3����I2���ں�3mol NaHSO3����Һ����μ���NaIO3��Һ������NaIO3�����ʵ�����������I2�����ʵ����Ĺ�ϵ������ͼ������˵����ȷ���� �� ��
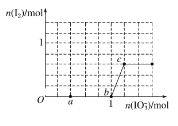
A. ��Ӧ�����е����������ΪNa2SO4
B. a��ʱ����NaHSO3�����ʵ���Ϊ1.0 mol
C. O��b��ķ�Ӧ�����������ӷ���ʽ��ʾ��3HSO3����IO3����3OH��===3SO42����I����3H2O
D. ����Һ��I����I2�����ʵ���֮��Ϊ5��3ʱ�������NaIO3Ϊ1.1 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Զ�����̼Ϊԭ�ϲ�������ĵ缫���ǿ���ԵĶ�����̼ˮ��Һ�ɵõ�����ȼ�ϣ���ԭ����ͼ��ʾ������˵������ȷ����
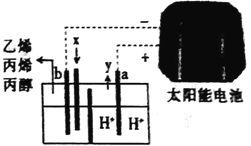
A. x�Ƕ�����̼��y������
B. ̫���ܵ���ǽ�����ת��Ϊ����
C. a �����������缫��b��һ��Ҫ�ö��Ե缫
D. b���ķ�Ӧ֮һΪ2CO2+12e-+12H+==C2H4+4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ԫ���У��䵥����������ǿ����( )
A. ԭ�Ӻ���δ�ɶԵ������ĵڶ�����Ԫ��
B. λ�����ڱ��е���������A���Ԫ��
C. ԭ�����������Ų�Ϊ2s22p4��Ԫ��
D. ��9��ԭ�ӹ���е����ҵ���������С��Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������������Ը��������Һ�������
A. ��ϩ����Ȳ B. 1һ��ϩ���ױ� C. ����1һ��Ȳ D. ����������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com