
【题目】已知NaHSO3溶液显酸性,还原性:HSO3->I-,氧化性:IO3->I2。在含3mol NaHSO3的溶液中逐滴加入NaIO3溶液。加入NaIO3的物质的量和析出的I2的物质的量的关系曲线如图。下列说法正确的是 ( )
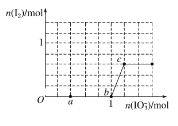
A. 反应过程中的氧化产物均为Na2SO4
B. a点时消耗NaHSO3的物质的量为1.0 mol
C. O~b间的反应可用如下离子方程式表示:3HSO3-+IO3-+3OH-===3SO42-+I-+3H2O
D. 当溶液中I-与I2的物质的量之比为5∶3时,加入的NaIO3为1.1 mol
【答案】D
【解析】
还原性HSO3->I-,所以首先是发生以下反应离子方程式:IO3-+3HSO3-═I-+3SO42-+3H+,继续加入KIO3,氧化性IO3->I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-═3H2O+3I2,A. 反应过程中的氧化产物分别为Na2SO4和I2,选项A错误;B.由图可知,a点碘酸钠的物质的量是0.4mol,根据碘酸钠和亚硫酸氢钠的关系式知,消耗NaHSO3的物质的量=![]() ×3=1.2mol,选项B错误;C、0~b间没有碘单质生成,说明碘酸根离子和亚硫酸氢根离子发生氧化还原反应生成碘离子,加入碘酸钠的物质的量是1mol,亚硫酸氢钠的物质的量是3mol,亚硫酸氢根被氧化生成硫酸根离子,根据转移电子守恒知,生成碘离子,所以其离子方程式为:3HSO3-+IO3-═3SO42-+I-+3H+,选项C错误;D、b点碘酸钠的物质的量是1mol,生成碘离子也是1mol。根据反应式IO3-+5I-+6H+=3I2+3H2O可知,如果设此时消耗碘离子的物质的量是x,则消耗碘酸钠就是
×3=1.2mol,选项B错误;C、0~b间没有碘单质生成,说明碘酸根离子和亚硫酸氢根离子发生氧化还原反应生成碘离子,加入碘酸钠的物质的量是1mol,亚硫酸氢钠的物质的量是3mol,亚硫酸氢根被氧化生成硫酸根离子,根据转移电子守恒知,生成碘离子,所以其离子方程式为:3HSO3-+IO3-═3SO42-+I-+3H+,选项C错误;D、b点碘酸钠的物质的量是1mol,生成碘离子也是1mol。根据反应式IO3-+5I-+6H+=3I2+3H2O可知,如果设此时消耗碘离子的物质的量是x,则消耗碘酸钠就是![]() ,生成单质碘是
,生成单质碘是![]() ,所以有(1-x)︰
,所以有(1-x)︰![]() =5∶3,解得x=
=5∶3,解得x=![]() 所以加入的的碘酸钠是1+
所以加入的的碘酸钠是1+![]() =1.1mol,选项D正确,答案选D。
=1.1mol,选项D正确,答案选D。


科目:高中化学 来源: 题型:
【题目】下图为1mol甲烧在足量的氧气中燃烧生成CO2(g)和H2O(g)时的能量变化示意图,由此图分析得出的下列结论中错误的是()

A. 该反应中反应物的总能量高于生成物的总能量
B. 甲烷的燃烧热△H =-802kJ mol-1
C. 该反应的活化能为213kJ mol-1
D. 该反应的热化学方程式为CH4(g)+202(g)=CO2(g)+2H2O(g) △H =-802kJ mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲、乙两个容积均为1 L的恒容容器中。现向甲中充入2 mol A、2 mol B,乙中充入1 mol A、1 mol B。相同温度下发生反应:A(g)+B(g) ![]() xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是 ( )
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是 ( )


A. x不可能等于1
B. 甲、乙两容器中反应达平衡时,平衡常数K甲<K乙
C. 将乙容器升温可使甲、乙容器内各物质的体积分数相同
D. 若向甲容器中再充入2 mol A、2 mol B,则平衡时甲中0.78 mol·L-1<c(A)<1.56 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)![]() 2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
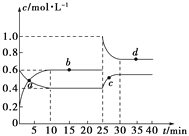
(1)该温度下,该反应的平衡常数为___________,若温度升高,K值将________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的是________点。从起点开始首次达到平衡时,以NO2表示的反应速率为________。
(3)25 min时,加入了________(填加入物质的化学式及加入的物质的量),使平衡发生了移动。
(4)d点对应NO2的物质的量浓度_______(填“大于”、“小于”或“等于”)0.8 mol·L-1,理由是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是A~F物质间的相互转化关系图。已知A~F中均含有一种相同的元素,B是一种工业产品,应用广泛,D在常温下是气体。C是单质,很脆的淡黄色晶体。C与F物质的量之比1∶1反应生成A。
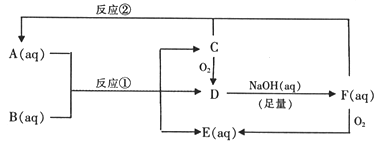
请回答:
(1)A的化学式________。
(2)反应①的离子方程式________。
(3)将C与过量浓NaOH溶液混合加热,有F生成。写出反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表中所列键能数据,判断下列分子中,最不稳定的分子是( )
化学键 | H—H | H—Cl | H—I | Cl—Cl | Br—Br |
键能/kJ/mol | 436 | 431 | 299 | 247 | 193 |
A.HClB.HBrC.H2D.Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些化学反应可用下式表示A+B→C+D+H2O。请回答下列问题(反应可以是固体之间的反应,也可以是在水溶液中进行的反应)。
(1)若A是非金属气态单质,反应后所得溶液常用于消毒、杀菌。则A为________(填化学式,下同)。反应的化学方程式为________________。
(2)若A为非金属固态单质,C、D均为气体且都能使澄清石灰水变浑浊。则A为________。反应的化学方程式为________________________________。
(3)若A为紫红色金属,D为有色气体。则A为______。反应的离子方程式为________________________________________。
(4)若A为烧碱溶液,C是相对分子质量为100的白色沉淀,D为正盐。则C为________。反应的离子方程式为___________________。
(5)若A、B为固体,C的水溶液能使酚酞溶液变为红色。实验室常用此反应制备C气体。则C为________。反应的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PET是世界上产量最大的合成纤维,其结构简式为:
![]()
现以煤的干馏产品A 与F 为原料制备PET,生产的工艺流程如图所示。
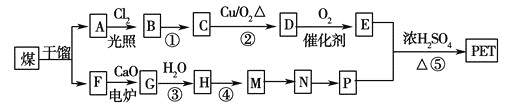
①A的分子式为C8H10,且能使酸性高锰酸钾溶液褪色,但不能使溴水褪色。
②M分子里所有原子共平面。
③G 为CaC2,其与H2O 反应时元素化合价不变。
请回答下列问题:
(1)A的名称为__________。M→N 的反应类型为__________;
(2)反应①的反应条件为:__________;
(3)写出有机物A 所有一氯代物的结构简式:__________。
(4)写出下列反应的化学方程式:
①D与足量的氢氧化铜悬浊液煮佛:__________;
②反应⑤:__________。
(5)P的一种同系物X的分子式为C3H8O2 ,在核磁共振氢谱图中出现三种信号峰,其峰的强度之比为2∶1∶1。则X 的结构简式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com