
【题目】以下是A~F物质间的相互转化关系图。已知A~F中均含有一种相同的元素,B是一种工业产品,应用广泛,D在常温下是气体。C是单质,很脆的淡黄色晶体。C与F物质的量之比1∶1反应生成A。
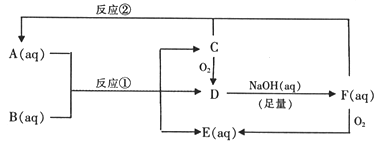
请回答:
(1)A的化学式________。
(2)反应①的离子方程式________。
(3)将C与过量浓NaOH溶液混合加热,有F生成。写出反应的化学方程式________。
【答案】 Na2S2O3 S2O32-+2H+=S↓+SO2↑+H2O 3S+6NaOH![]() Na2SO3+2Na2S+3H2O
Na2SO3+2Na2S+3H2O
【解析】本题考查无机推断题,C为单质,很脆的淡黄色晶体,即C为S,S与氧气反应生成SO2,即D为SO2,因为NaOH是足量,因此SO2与NaOH反应生成Na2SO3,Na2SO3容易被氧气氧化成Na2SO4,即E为Na2SO4,SO2和Na2SO3按照物质的量之比为1:1进行反应,即A为Na2S2O3,因为A到F含有一种相同的元素,即B为H2SO4,(1)根据上述分析,得出A为Na2S2O3;(2)反应①的离子方程式为S2O32-+2H+=S↓+SO2↑+H2O;(3)S能与热的NaOH溶液发生反应,化学反应反应方程式为3S+6NaOH=Na2SO3+2Na2S+3H2O。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】氮氧化物能形成酸雨和光化学烟雾,严重污染环境。燃煤和机动车尾气是氮氧化物的主要来源。现在对其中的一些气体进行了一定的研究:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) △H= 574 kJ·moll
4NO(g)+CO2(g)+2H2O(g) △H= 574 kJ·moll
②CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) △H= 1160 kJ·moll
2N2(g)+CO2(g)+2H2O(g) △H= 1160 kJ·moll
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式______________________________________________________。
(2)在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体。T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,在一定条件下发生反应,反应过程中NO的物质的量随时间变化如图所示。
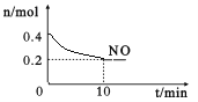
①写出该反应的化学方程式______________________________________。
②10 min内该反应的速率v(CO)=__________________;T℃时,该化学反应的平衡常数K=_______。
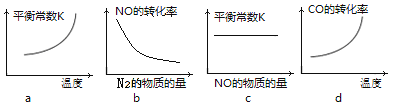
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____________。(填序号)
④一定温度下,在恒容密闭容器中充入一定量NO和CO进行该反应,下列选项能判断反应已达到化学平衡状态的是____________。
a.容器中压强不再变化 b.CO2的浓度不再变化
c.2v正(NO)=v逆(N2) d.气体的密度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应容器中充入1molA气体和n molB气体,在一定条件下发生反应:A(气)+nB(气)![]() mC(气),达平衡时,测得A的转化率为50%,在相同温度和相同压强下,平衡时混合气体的体积是反应前的
mC(气),达平衡时,测得A的转化率为50%,在相同温度和相同压强下,平衡时混合气体的体积是反应前的 ![]() ,则n和m的数值可能是( )
,则n和m的数值可能是( )
A. n=1 m=1 B. n=2 m=2
C. n=3 m=3 D. n=2 m=3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组制备肥皂的过程如下:
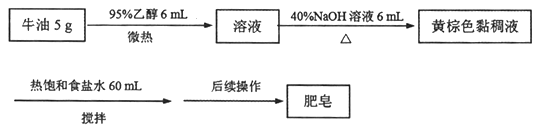
请回答:
(1)加入乙醇的目的是________;“后续操作”指________。
(2)证明牛油已反应完全的方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO3溶液显酸性,还原性:HSO3->I-,氧化性:IO3->I2。在含3mol NaHSO3的溶液中逐滴加入NaIO3溶液。加入NaIO3的物质的量和析出的I2的物质的量的关系曲线如图。下列说法正确的是 ( )
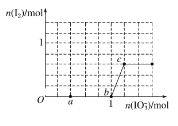
A. 反应过程中的氧化产物均为Na2SO4
B. a点时消耗NaHSO3的物质的量为1.0 mol
C. O~b间的反应可用如下离子方程式表示:3HSO3-+IO3-+3OH-===3SO42-+I-+3H2O
D. 当溶液中I-与I2的物质的量之比为5∶3时,加入的NaIO3为1.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三苯甲基正离子、三苯甲基负离子、三苯甲基自由基三种粒子分别为![]() 、
、![]() 、
、![]() 。下列说法不正确的是
。下列说法不正确的是
A. 甲苯的一氯代物有4种 B. 三苯甲基负离子水解可制备三苯甲醇
C. 等质量的上述三种粒子所含的质子数相同 D. 1mol三苯甲基正离子含128 mol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )

A. HA为强酸 B. 该混合液pH=7
C. 图中X表示HA,Y表示OH-,Z表示H+ D. 该混合溶液中:c(A—)+ c(Y)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气(CO+H2) 广泛用于合成有机物,工业上常采用天然气与水蒸气反应等方法来制取合成气,
(1)已知标况下,5.6LCH4与水蒸气完全反应时吸收51.5kJ的热量,请写出该反应的热化学方程式________________;
(2)在150℃时2L 的密闭容器中,将2molCH4和2mol H2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%。回答下列问题:
①从反应开始至平衡,用氢气的变化量来表示该反应速率v(H2)=________。
②在该温度下,计算该反应的平衡常数K=________。
③下列选项中能表示该反应已达到平衡状态的是________。
A.V(H2)逆=3v (CO)正 B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变 D.C(CH4)=C(CO)
(3)合成气中的氢气也用于合成氨气:N2+3H2![]() 2NH3。保持温度和体积不变,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是_______________;
2NH3。保持温度和体积不变,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是_______________;
容器 | 体积 | 起始物质 | 平衡时NH3的物质的量 | 平衡时N2 的体积分数 | 反应开始时的速率 | 平衡时容器内压强 |
甲 | 1L | 1molN2+3molH2 | 1.6mol | φ甲 | v甲 | P甲 |
乙 | 1L | 2molN2+6molH2 | n1 mol | φ乙 | v乙 | P乙 |
丙 | 2L | 2molN2+6molH2 | n2 mol | φ丙 | v丙 | P丙 |
A.n1=n2=3.2 B.φ甲=φ丙>φ乙 C.v乙 >v>v甲 D.P乙>P甲=P丙
(4)合成气可以制取甲醚,绿色电源“二甲醚-氧气燃料电池”工作原理如下图所示
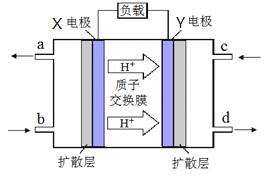
① 电极Y 上发生的反应式为__________ ;
②电池在放电过程中,电极X周围溶液的pH_______(填“增大、减小、不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com