
【题目】某些化学反应可用下式表示A+B→C+D+H2O。请回答下列问题(反应可以是固体之间的反应,也可以是在水溶液中进行的反应)。
(1)若A是非金属气态单质,反应后所得溶液常用于消毒、杀菌。则A为________(填化学式,下同)。反应的化学方程式为________________。
(2)若A为非金属固态单质,C、D均为气体且都能使澄清石灰水变浑浊。则A为________。反应的化学方程式为________________________________。
(3)若A为紫红色金属,D为有色气体。则A为______。反应的离子方程式为________________________________________。
(4)若A为烧碱溶液,C是相对分子质量为100的白色沉淀,D为正盐。则C为________。反应的离子方程式为___________________。
(5)若A、B为固体,C的水溶液能使酚酞溶液变为红色。实验室常用此反应制备C气体。则C为________。反应的化学方程式为_____________________。
【答案】Cl22NaOH+Cl2=NaCl+NaClO+H2OCC+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2OCuCu+4H++2NO3-=Cu2++2H2O+2NO2↑CaCO32OH-+Ca2++2HCO3-=2H2O+CaCO3↓+CO32-NH3Ca(OH)2+2NH4Cl
CO2↑+2SO2↑+2H2OCuCu+4H++2NO3-=Cu2++2H2O+2NO2↑CaCO32OH-+Ca2++2HCO3-=2H2O+CaCO3↓+CO32-NH3Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
【解析】
(1)若A是非金属气态单质,反应后所得溶液常用于消毒、杀菌,该反应是氯气与氢氧化钠的反应,则A为Cl2,该反应的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O;
(2)若A为非金属固态单质,C、D均为气体且都能使澄清石灰水变浑浊,C、D分别为CO2、SO2中的一种,则该反应为碳与浓硫酸反应,故A为C,反应的化学方程式为C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;
(3)若A为紫红色金属,则A为Cu,D为有色气体,该反应为Cu与浓硝酸反应,反应的离子方程式为Cu+4H++2NO3-=Cu2++2H2O+2NO2↑;
(4)若A为烧碱溶液,C是相对分子质量为100的白色沉淀,C为CaCO3,D为正盐,应是碳酸氢钙与氢氧化钠反应生成碳酸钙、碳酸钠与水,反应的离子方程式为2OH-+Ca2++2HCO3-=2H2O+CaCO3↓+CO32-;
(5)若A、B为固体,C的水溶液能使酚酞溶液变为红色,实验室常用此反应制备C气体,则C为NH3,该反应为氢氧化钙与氯化铵反应生成氯化钙、氨气与水,反应的化学方程式为Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。


科目:高中化学 来源: 题型:
【题目】人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2![]() O2+HbCO,37℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。下列结论错误的是( )
O2+HbCO,37℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。下列结论错误的是( )
A. CO与HbO2反应的平衡常数K=![]()
B. 当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
C. 人体吸入的CO越多,与血红蛋白结合的O2越少
D. 把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO3溶液显酸性,还原性:HSO3->I-,氧化性:IO3->I2。在含3mol NaHSO3的溶液中逐滴加入NaIO3溶液。加入NaIO3的物质的量和析出的I2的物质的量的关系曲线如图。下列说法正确的是 ( )
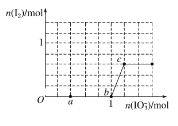
A. 反应过程中的氧化产物均为Na2SO4
B. a点时消耗NaHSO3的物质的量为1.0 mol
C. O~b间的反应可用如下离子方程式表示:3HSO3-+IO3-+3OH-===3SO42-+I-+3H2O
D. 当溶液中I-与I2的物质的量之比为5∶3时,加入的NaIO3为1.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三苯甲基正离子、三苯甲基负离子、三苯甲基自由基三种粒子分别为![]() 、
、![]() 、
、![]() 。下列说法不正确的是
。下列说法不正确的是
A. 甲苯的一氯代物有4种 B. 三苯甲基负离子水解可制备三苯甲醇
C. 等质量的上述三种粒子所含的质子数相同 D. 1mol三苯甲基正离子含128 mol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种元素中,其单质氧化性最强的是( )
A. 原子含有未成对电子最多的第二周期元素
B. 位于周期表中第三周期ⅢA族的元素
C. 原子最外层电子排布为2s22p4的元素
D. 有9个原子轨道有电子且电子总数最小的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )

A. HA为强酸 B. 该混合液pH=7
C. 图中X表示HA,Y表示OH-,Z表示H+ D. 该混合溶液中:c(A—)+ c(Y)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组通过实验探究NO2的性质。已知:2NO2+2NaOH===NaNO3+NaNO2+H2O。
任务1:利用如图所示装置探究NO2能否被NH3还原(夹持固定装置已略去)。
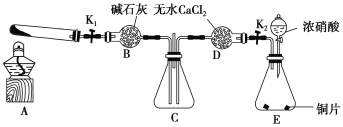
请回答下列问题:
(1)E装置中制取NO2的化学方程式是_____________________________。
(2)若NO2能被NH3还原,预期观察到C装置中的现象是________________。
(3)此实验装置存在的一个明显缺陷是_______________________________________。
任务2:探究NO2能否与Na2O2发生氧化还原反应。
(4)实验前,该小组同学提出三种假设。
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3:________________________________________________。
(5)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图所示),重新组装,进行实验。
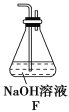
①装置的合理连接顺序是(某些装置可以重复使用)_________________。
②实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中发生反应的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铟(In2O3)用作光谱纯试剂、光电显示半导体薄膜和电子元件的材料等,铟产业被称为“信息时代的朝阳产业”。利用水铟矿[主要成分为In(OH)3]制备In2O3的工艺流程如下:
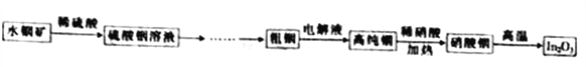
已知:常温下Ksp[In(OH)3]=1.41×10-33。
回答下列问题:
(1)In2O3中In的化合价为_________________。
(2)用硫酸酸浸水铟矿时发生反应的离子方程式为(杂质不参与反应)_________________。
(3)用硫酸从水铟矿中提取铟时,酸度与浸出率关系如图,则适宜硫酸的物质的量浓度为______。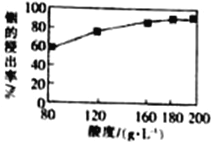
(4)高纯铟与稀硝酸反应的离子方程式为_________________。
(5)硝酸铟高温下生成氧化铟的同时又红棕色气体产生。写出该反应的化学方程式:________。
(6)粗铟电解精炼为高纯铟时、阳极的电极反应为_________________。
(7)水铟矿溶于硫酸中得到c(In3+)=1.41mol·L-1,要使In3+不产生沉淀,计算此时溶液的pH(写出必要的计算式)___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com