
【题目】下列四种元素中,其单质氧化性最强的是( )
A. 原子含有未成对电子最多的第二周期元素
B. 位于周期表中第三周期ⅢA族的元素
C. 原子最外层电子排布为2s22p4的元素
D. 有9个原子轨道有电子且电子总数最小的元素
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)![]() 2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
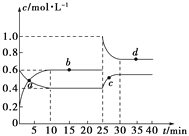
(1)该温度下,该反应的平衡常数为___________,若温度升高,K值将________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的是________点。从起点开始首次达到平衡时,以NO2表示的反应速率为________。
(3)25 min时,加入了________(填加入物质的化学式及加入的物质的量),使平衡发生了移动。
(4)d点对应NO2的物质的量浓度_______(填“大于”、“小于”或“等于”)0.8 mol·L-1,理由是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表中所列键能数据,判断下列分子中,最不稳定的分子是( )
化学键 | H—H | H—Cl | H—I | Cl—Cl | Br—Br |
键能/kJ/mol | 436 | 431 | 299 | 247 | 193 |
A.HClB.HBrC.H2D.Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出的有关表述中不准确的是
序号 | A | B | C | D |
物质类型 | 离子化合物 | 共价键直接构成的物质 | 共价分子 | 稀有气体 |
代表物质 | NaCl | 金刚石 | 干冰 | Ne |
组成晶体的结构微粒 | Na+、Cl- | C | CO2 | Ne |
结构微粒间相互作用 | 离子键 | 共价键 | 分子间作用力 | 共价键 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些化学反应可用下式表示A+B→C+D+H2O。请回答下列问题(反应可以是固体之间的反应,也可以是在水溶液中进行的反应)。
(1)若A是非金属气态单质,反应后所得溶液常用于消毒、杀菌。则A为________(填化学式,下同)。反应的化学方程式为________________。
(2)若A为非金属固态单质,C、D均为气体且都能使澄清石灰水变浑浊。则A为________。反应的化学方程式为________________________________。
(3)若A为紫红色金属,D为有色气体。则A为______。反应的离子方程式为________________________________________。
(4)若A为烧碱溶液,C是相对分子质量为100的白色沉淀,D为正盐。则C为________。反应的离子方程式为___________________。
(5)若A、B为固体,C的水溶液能使酚酞溶液变为红色。实验室常用此反应制备C气体。则C为________。反应的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.01mol/LNaOH溶液滴定20.00mL0.01mol/LCH 3COOH溶液,所得滴定曲线如右图。下列说法正确的是
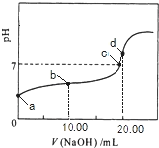
A. b点对应的溶液中: c(OH—)+c(CH3COO—) = c(Na+)+c(H+)
B. a点对应溶液的pH= 2
C. C点表示NaOH溶液与CH3COOH溶液恰好完全反应
D. d点对应的溶液中,水的电离程度小于同温下纯水的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨、磷属于同一主族元素,是组成生命体的重要元素,其单质及化合物用途广泛。回答下列问题:
(1)基态P原子的核外电子排布式为_____,磷及其同周期相邻元素第一电离能由大到小的顺序是______________________。
(2)NH3比PH3易液化的原因是______________________。
(3)自然固氨现象发生的一系列化学变化:N2→NO→NO2→HNO3→NO3-解释了民谚“雷雨发庄稼”的原理。
①N2分子结构中。σ键和π键之比为_________,己知N![]() N的键能为946kJ·mol-1,远大于N—N的键能(193 kJ·mol-1)的三倍,原因是______________________。
N的键能为946kJ·mol-1,远大于N—N的键能(193 kJ·mol-1)的三倍,原因是______________________。
②NO3-中N原子采取___________杂化方式,其空间构型为__________,写出它的一种等电子体的化学式_____________________。
③已知酸性:HNO3>HNO2,下列相关见解合理的是_________________。
A.含氧酸中氧原子总数越多,酸性越强
B.同种元素化合价越高,对应含氧酸的酸性越强
C.HNO3中氮元素的正电性更高,在水溶液中更易电离出H+,酸性强于HNO2
(4)磷化硬(BP)是一种超硬耐磨涂层材料,其晶胞结构如图所示,图中a点和b点的原子坐标参数依次为(0,0,0)、(![]() ,
, ![]() ,
, ![]() ),则c 点的原子坐标参数为_______。已知该晶体密度为ρg·cm-3,则B-P键的键长为_____pm (阿伏加德罗常数用NA表示,列出计算式即可)。
),则c 点的原子坐标参数为_______。已知该晶体密度为ρg·cm-3,则B-P键的键长为_____pm (阿伏加德罗常数用NA表示,列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬及其化合物在工业生产中有重要的用途。
(1)向Na2CrO4溶液中加入稀硫酸酸化,会生成Na2Cr2O7(重铬酸钠),酸化过程中发生反应的离子方程式为______________。不能选用盐酸进行酸化的原因是______________。
(2)重铬酸钾(K2Cr2O7)可用于检验酒驾,其原理是人呼出的乙醇会使硫酸酸化的重铬酸钾硅胶变为灰绿色的硫酸铬[Cr2(SO4)3],乙醇被氧化成乙酸,写出反应的离子方程式:______________。
(3)已知常温下Ksp[Cr(OH)3]=6.0×10-31,在Cr2(SO4)3溶液中滴加NaOH溶液调节至溶液中c(Cr3+)=6.0×10-16 mol/L时,溶液的pH=______________。
(4)用氧化还原滴定法可测定废水中Cr2O72-的浓度。取100 mL废水样品,加入少许稀硫酸和过量的KI溶液,充分反应后滴入几滴淀粉溶液,用0.2 mol/L的Na2S2O3溶液滴定生成的I2,当滴入30 mL Na2S2O3溶液时恰好反应完全,反应的原理是Cr2O72-+14H++6I- =3I2 +2Cr3++7H2O;I2 +2S2O32- =2I- +S4O62-,则该废水中Cr2O72-的物质的量浓度是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com