
����Ŀ������������ͬһ����Ԫ�أ���������������ҪԪ�أ��䵥�ʼ���������;�㷺���ش�����������
��1����̬Pԭ�ӵĺ�������Ų�ʽΪ_____������ͬ��������Ԫ�ص�һ�������ɴ�С��˳����______________________��
��2��NH3��PH3��Һ����ԭ����______________________��
��3����Ȼ�̰���������һϵ�л�ѧ�仯��N2��NO��NO2��HNO3��NO3-���������衰���귢ׯ�ڡ���ԭ����
��N2���ӽṹ�С�����������֮��Ϊ_________����֪N![]() N�ļ���Ϊ946kJ��mol-1��Զ����N��N�ļ���(193 kJ��mol-1)��������ԭ����______________________��
N�ļ���Ϊ946kJ��mol-1��Զ����N��N�ļ���(193 kJ��mol-1)��������ԭ����______________________��
��NO3-��Nԭ�Ӳ�ȡ___________�ӻ���ʽ����ռ乹��Ϊ__________��д������һ�ֵȵ�����Ļ�ѧʽ_____________________��
����֪������HNO3>HNO2��������ؼ����������_________________��
A.����������ԭ������Խ�࣬����Խǿ
B.ͬ��Ԫ�ػ��ϼ�Խ�ߣ���Ӧ�����������Խǿ
C.HNO3�е�Ԫ�ص������Ը��ߣ���ˮ��Һ�и������H+������ǿ��HNO2
��4����Ӳ(BP)��һ�ֳ�Ӳ��ĥͿ����ϣ��侧���ṹ��ͼ��ʾ��ͼ��a���b���ԭ�������������Ϊ��0��0��0������![]() ��
�� ![]() ��
�� ![]() ������c ���ԭ���������Ϊ_______����֪�þ����ܶ�Ϊ��g��cm-3����B-P���ļ���Ϊ_____pm �������ӵ�������NA��ʾ���г�����ʽ��������
������c ���ԭ���������Ϊ_______����֪�þ����ܶ�Ϊ��g��cm-3����B-P���ļ���Ϊ_____pm �������ӵ�������NA��ʾ���г�����ʽ��������

���𰸡� 1s22s22p63s2p3 P>S>Si NH3���Ӽ������� 1:2 N![]() N�еĵ�ԭ�Ӵﵽ8���ӵ�����ȶ��ṹ sp2 ƽ�������� SO3��O4 BC ��1��
N�еĵ�ԭ�Ӵﵽ8���ӵ�����ȶ��ṹ sp2 ƽ�������� SO3��O4 BC ��1�� ![]() ��
�� ![]() ��
��  ��1010
��1010
��������(1).PΪ15��Ԫ�أ���������Ϊ3��5���ܼ�����Ϊ1s22s22p63s23p3��ͬ�����������ҵ�һ������������P��3p�ܼ�Ϊ�����״̬���Ƚ��ȶ�������P>S>Si ��
��2��NH3���Ӽ������������Ӽ���������ǿ��Ϊ��Һ�����壻
��3����N2�����γɵ��ǹ���������������һ��������������������������������֮��Ϊ1:2��
��ѧ��Խ�ȶ�������Խ��N![]() N�еĵ�ԭ�Ӵﵽ8���ӵ�����ȶ��ṹ�����������Զ��������N��N�ļ��ܡ�
N�еĵ�ԭ�Ӵﵽ8���ӵ�����ȶ��ṹ�����������Զ��������N��N�ļ��ܡ�
���������Nԭ�Ӽ۵��Ӳ����Ϊ3��,����ģ��Ϊƽ��������,û�йµ��Ӷԣ����ӻ���ʽΪsp2�ӻ����������Ϊ�ȵ����������Ϊ��SO3��O4��BF3��
��A. ͬ��Ԫ�ػ��ϼ�Խ�ߣ�����������ԭ������Խ������Խǿ��A��ƫ��ȫ������B.��A�ã�B��ȷ��C. HNO3�е�Ԫ�صõ���������ǿ���������HNO2���Ը�ǿ��C��ȷ������ѡ��BC��
��4����b������þ����߳�Ϊ1��cλ�ڲ��������ģ�����������Ϊ��1�� ![]() ��
�� ![]() ��������֪��b����4��Pԭ��Χ�ɵ�������������ģ�Pԭ��λ�ڶ��㣬��B-P���ij���Ϊ
��������֪��b����4��Pԭ��Χ�ɵ�������������ģ�Pԭ��λ�ڶ��㣬��B-P���ij���Ϊ![]() ��
��
lΪ�����߳�= ������B-P���ij���Ϊ
������B-P���ij���Ϊ pm��
pm��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ba(NO3)2��AgNO3��Fe(NO3)3�Ļ��Һ������Ba2����Ag����Fe3�����룬�ֱ�õ�����Ԫ�صIJ��������ͼ��ʾʵ�飺

(1)������Լ�(д��ѧʽ)��X________��Y________��Z________��
���ɵij���(д��ѧʽ)��A________��B________��C________��
(2)д����Ӧ�٢ڢ۵����ӷ���ʽ��
��_____________________________________________________________��
��_____________________________________________________________��
��_____________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ԫ���У��䵥����������ǿ����( )
A. ԭ�Ӻ���δ�ɶԵ������ĵڶ�����Ԫ��
B. λ�����ڱ��е���������A���Ԫ��
C. ԭ�����������Ų�Ϊ2s22p4��Ԫ��
D. ��9��ԭ�ӹ���е����ҵ���������С��Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ����С��ͨ��ʵ��̽��NO2�����ʡ���֪��2NO2+2NaOH===NaNO3+NaNO2+H2O��
����1��������ͼ��ʾװ��̽��NO2�ܷ�NH3��ԭ(�г̶ֹ�װ������ȥ)��
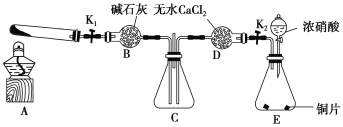
��ش��������⣺
��1��Eװ������ȡNO2�Ļ�ѧ����ʽ��_____________________________��
��2����NO2�ܱ�NH3��ԭ��Ԥ�ڹ۲쵽Cװ���е�������________________��
��3����ʵ��װ�ô��ڵ�һ������ȱ����_______________________________________��
����2��̽��NO2�ܷ���Na2O2����������ԭ��Ӧ��
��4��ʵ��ǰ����С��ͬѧ������ּ��衣
����1�����߲���Ӧ��
����2��NO2�ܱ�Na2O2������
����3��________________________________________________��
��5��Ϊ����֤����2����С��ͬѧѡ������1�е�B��D��Eװ�ã���B�е�ҩƷ����ΪNa2O2����ѡFװ��(��ͼ��ʾ)��������װ������ʵ�顣
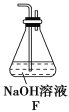
��װ�õĺ�������˳����(ijЩװ�ÿ����ظ�ʹ��)_________________��
��ʵ������У�Bװ���е���ɫ��ĩ��ɰ�ɫ�������飬�ð�ɫ����Ϊ��������������������ɡ��Ʋ�Bװ���з�����Ӧ�Ļ�ѧ����ʽΪ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����������Һ���ܴ���������ǣ� ��
A.Na+��Mg2+��Cl����SO42��
B.Cu2+��Cl����NO3����OH��
C.Ca2+��Na+��CO32����NO3��
D.K+��Fe3+��NO3����SCN��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������In2O3���������״��Լ��������ʾ�뵼�屡Ĥ�͵���Ԫ���IJ��ϵȣ�����ҵ����Ϊ����Ϣʱ���ij�����ҵ��������ˮ����[��Ҫ�ɷ�ΪIn(OH)3]�Ʊ�In2O3�Ĺ����������£�
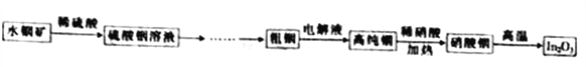
��֪��������Ksp[In(OH)3]=1.41��10-33��
�ش��������⣺
��1��In2O3��In�Ļ��ϼ�Ϊ_________________��
��2�����������ˮ����ʱ������Ӧ�����ӷ���ʽΪ�����ʲ����뷴Ӧ��_________________��
��3���������ˮ��������ȡ��ʱ�����������ʹ�ϵ��ͼ����������������ʵ���Ũ��Ϊ______��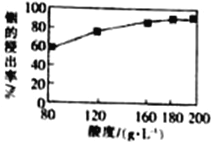
��4���ߴ�����ϡ���ᷴӦ�����ӷ���ʽΪ_________________��
��5��������������������������ͬʱ�ֺ���ɫ���������д���÷�Ӧ�Ļ�ѧ����ʽ��________��
��6��������⾫��Ϊ�ߴ���ʱ�������ĵ缫��ӦΪ_________________��
��7��ˮ�������������еõ�c(In3+)=1.41mol��L-1��ҪʹIn3+�����������������ʱ��Һ��pH��д����Ҫ�ļ���ʽ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������������Ը��������Һ�������
A. ��ϩ����Ȳ B. 1һ��ϩ���ױ� C. ����1һ��Ȳ D. ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.����ˮ���Ե���Ļ�����һ�������ӻ�����
B.�����ӻ������п��ܴ��ڹ��ۼ�
C.�ڹ��ۻ������п��ܴ������Ӽ�
D.���й��ۼ��Ļ�����һ���ǹ��ۻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ϲ��ںϳɰ���Ӧ�������й�������ȷ����
A.H2��ȫ��ת��ΪNH3B.���¿ɼ�С��Ӧ����
C.�÷�Ӧ�ǿ��淴ӦD.��ѹ�ɼ�С��Ӧ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com