
【题目】下列说法正确的是( )
A.溶于水可以导电的化合物一定是离子化合物
B.在离子化合物中可能存在共价键
C.在共价化合物中可能存在离子键
D.含有共价键的化合物一定是共价化合物
科目:高中化学 来源: 题型:
【题目】根据下表中所列键能数据,判断下列分子中,最不稳定的分子是( )
化学键 | H—H | H—Cl | H—I | Cl—Cl | Br—Br |
键能/kJ/mol | 436 | 431 | 299 | 247 | 193 |
A.HClB.HBrC.H2D.Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨、磷属于同一主族元素,是组成生命体的重要元素,其单质及化合物用途广泛。回答下列问题:
(1)基态P原子的核外电子排布式为_____,磷及其同周期相邻元素第一电离能由大到小的顺序是______________________。
(2)NH3比PH3易液化的原因是______________________。
(3)自然固氨现象发生的一系列化学变化:N2→NO→NO2→HNO3→NO3-解释了民谚“雷雨发庄稼”的原理。
①N2分子结构中。σ键和π键之比为_________,己知N![]() N的键能为946kJ·mol-1,远大于N—N的键能(193 kJ·mol-1)的三倍,原因是______________________。
N的键能为946kJ·mol-1,远大于N—N的键能(193 kJ·mol-1)的三倍,原因是______________________。
②NO3-中N原子采取___________杂化方式,其空间构型为__________,写出它的一种等电子体的化学式_____________________。
③已知酸性:HNO3>HNO2,下列相关见解合理的是_________________。
A.含氧酸中氧原子总数越多,酸性越强
B.同种元素化合价越高,对应含氧酸的酸性越强
C.HNO3中氮元素的正电性更高,在水溶液中更易电离出H+,酸性强于HNO2
(4)磷化硬(BP)是一种超硬耐磨涂层材料,其晶胞结构如图所示,图中a点和b点的原子坐标参数依次为(0,0,0)、(![]() ,
, ![]() ,
, ![]() ),则c 点的原子坐标参数为_______。已知该晶体密度为ρg·cm-3,则B-P键的键长为_____pm (阿伏加德罗常数用NA表示,列出计算式即可)。
),则c 点的原子坐标参数为_______。已知该晶体密度为ρg·cm-3,则B-P键的键长为_____pm (阿伏加德罗常数用NA表示,列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PET是世界上产量最大的合成纤维,其结构简式为:
![]()
现以煤的干馏产品A 与F 为原料制备PET,生产的工艺流程如图所示。
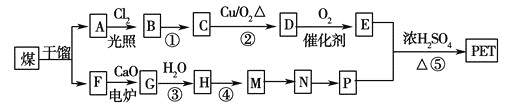
①A的分子式为C8H10,且能使酸性高锰酸钾溶液褪色,但不能使溴水褪色。
②M分子里所有原子共平面。
③G 为CaC2,其与H2O 反应时元素化合价不变。
请回答下列问题:
(1)A的名称为__________。M→N 的反应类型为__________;
(2)反应①的反应条件为:__________;
(3)写出有机物A 所有一氯代物的结构简式:__________。
(4)写出下列反应的化学方程式:
①D与足量的氢氧化铜悬浊液煮佛:__________;
②反应⑤:__________。
(5)P的一种同系物X的分子式为C3H8O2 ,在核磁共振氢谱图中出现三种信号峰,其峰的强度之比为2∶1∶1。则X 的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.双氧水(主要成分H2O2)是常见的氧化剂、还原剂。
(1)如下图是工业上制备过氧化氢最常见的方法,写出实际发生反应的总方程式____________。

(2)H2O2可看作二元弱酸,写出它在水中第一步电离的方程式______________________________。
II.A、B、C、D、E、X是中学常见的无机物,存在如下图转化关系(部分生成物和反应条件略去)。

(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:__________________________________________________________________________________。
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则X可能为______________________(填代号)。
a.NaHCO3 b.Na2CO3 c.Fe(OH)3 d.Na[Al(OH)4]
(3)若A为淡黄色粉末,则A的电子式为____________________。若X为一种最常见的造成温室效应的气体。则鉴别等浓度的D、E两种溶液,可选择的试剂为__________(填代号)。
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Ca(OH)2溶液
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红。则A与H2O反应的化学反应方程式为________________________________,E是__________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市中考化学实验操作考试有四个考题:①蒸馏;②H2的化学性质;③二氧化碳的制取、收集和验满;④氧气的制取、收集和验满。考试的方法是由考生抽签确定考题,小凯同学抽签后被监考老师引导至准备了下列仪器和药品的实验台前:

请回答:
(1)指出上图中仪器a的名称:_______;
(2)由实验台上提供的仪器和药品,你认为小凯抽到的是第____个考题;
(3)以下是小凯完成该实验主要操作过程的示意图。按评分标准,每项操作正确得1分,满分5分,实验完毕后小凯得了3分。请找出他失分的操作并说明原因:______________________、______________________;
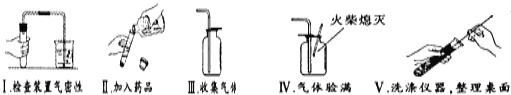
(4)仅用上述仪器(药品另选),也能完成另一种常见气体的实验室制取,化学方程式为:______________;若增加________ (填一种玻璃仪器名称)还能组装成高锰酸钾制氧气的发生装置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬及其化合物在工业生产中有重要的用途。
(1)向Na2CrO4溶液中加入稀硫酸酸化,会生成Na2Cr2O7(重铬酸钠),酸化过程中发生反应的离子方程式为______________。不能选用盐酸进行酸化的原因是______________。
(2)重铬酸钾(K2Cr2O7)可用于检验酒驾,其原理是人呼出的乙醇会使硫酸酸化的重铬酸钾硅胶变为灰绿色的硫酸铬[Cr2(SO4)3],乙醇被氧化成乙酸,写出反应的离子方程式:______________。
(3)已知常温下Ksp[Cr(OH)3]=6.0×10-31,在Cr2(SO4)3溶液中滴加NaOH溶液调节至溶液中c(Cr3+)=6.0×10-16 mol/L时,溶液的pH=______________。
(4)用氧化还原滴定法可测定废水中Cr2O72-的浓度。取100 mL废水样品,加入少许稀硫酸和过量的KI溶液,充分反应后滴入几滴淀粉溶液,用0.2 mol/L的Na2S2O3溶液滴定生成的I2,当滴入30 mL Na2S2O3溶液时恰好反应完全,反应的原理是Cr2O72-+14H++6I- =3I2 +2Cr3++7H2O;I2 +2S2O32- =2I- +S4O62-,则该废水中Cr2O72-的物质的量浓度是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 向0.1 molL-1CH3COOH溶液中加入少量水,溶液中 减小
减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中  增大
增大
C. 向盐酸中加入氨水至中性,溶液中 >1
>1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3溶液中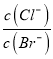 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A. 0.1 mol CH4分子所含质子数为1.6 NA
B. 在0℃,101kPa时,22.4 L H2中含有NA个氢原子
C. 16 g氧气和16 g臭氧所含的原子数均为NA
D. NA个CO分子和11.2L CH4的质量比为7:4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com