
【题目】下列各组离子在溶液中能大量共存的是( )
A.Na+、Mg2+、Cl﹣、SO42﹣
B.Cu2+、Cl﹣、NO3﹣、OH﹣
C.Ca2+、Na+、CO32﹣、NO3﹣
D.K+、Fe3+、NO3﹣、SCN﹣
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:2CrO42-+2H+![]() Cr2O72-+H2O。25℃时,调节初始浓度为1.0mol·L-1的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如下曲线。下列说法不正确的是( )
Cr2O72-+H2O。25℃时,调节初始浓度为1.0mol·L-1的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如下曲线。下列说法不正确的是( )

A. 平衡时,pH越小,c(Cr2O72-)越大
B. A、B两点c(CrO42-)之比为5:2
C. B点CrO42-的平衡转化率为40%
D. 平衡时,若溶液中c(CrO42-)=2c(Cr2O72-),则c(H+)=1.0×10-7mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出的有关表述中不准确的是
序号 | A | B | C | D |
物质类型 | 离子化合物 | 共价键直接构成的物质 | 共价分子 | 稀有气体 |
代表物质 | NaCl | 金刚石 | 干冰 | Ne |
组成晶体的结构微粒 | Na+、Cl- | C | CO2 | Ne |
结构微粒间相互作用 | 离子键 | 共价键 | 分子间作用力 | 共价键 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.01mol/LNaOH溶液滴定20.00mL0.01mol/LCH 3COOH溶液,所得滴定曲线如右图。下列说法正确的是
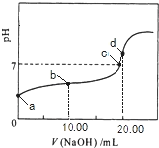
A. b点对应的溶液中: c(OH—)+c(CH3COO—) = c(Na+)+c(H+)
B. a点对应溶液的pH= 2
C. C点表示NaOH溶液与CH3COOH溶液恰好完全反应
D. d点对应的溶液中,水的电离程度小于同温下纯水的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其氧化物是日常生活生产中应用广泛的材料,请回答下列问题:
(1)基态铁原子的价电子排布式为_________。
(2)Fe3+、Co3+与N3+、CN-等可形成络合离子。
①C、N、O中第一电离能最大的为________,其原因是_____________________。
②K3[Fe(CN)6]可用于检验Fe2+,1mol K3[Fe(CN)6]中含有σ键的数目为________________。
(3)铁的另一种配合物Fe(CO)x的中心原子价电子数与配体提供的电子数之和为18,则x=_____。已
知该配合物的熔点为-20.5 ℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)x晶体属于_____________(填晶体类型)。
(4)金属铁晶体中原子采用_________堆积,铁晶体的空间利用率为______(用含π的式子表示)。
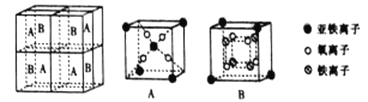
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B 方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比为_______________(填最简整数比);已知该晶体的密度为d g·cm-3,阿伏加德罗常数的值为NA,则晶胞参数a为_______________nm(用含d和NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨、磷属于同一主族元素,是组成生命体的重要元素,其单质及化合物用途广泛。回答下列问题:
(1)基态P原子的核外电子排布式为_____,磷及其同周期相邻元素第一电离能由大到小的顺序是______________________。
(2)NH3比PH3易液化的原因是______________________。
(3)自然固氨现象发生的一系列化学变化:N2→NO→NO2→HNO3→NO3-解释了民谚“雷雨发庄稼”的原理。
①N2分子结构中。σ键和π键之比为_________,己知N![]() N的键能为946kJ·mol-1,远大于N—N的键能(193 kJ·mol-1)的三倍,原因是______________________。
N的键能为946kJ·mol-1,远大于N—N的键能(193 kJ·mol-1)的三倍,原因是______________________。
②NO3-中N原子采取___________杂化方式,其空间构型为__________,写出它的一种等电子体的化学式_____________________。
③已知酸性:HNO3>HNO2,下列相关见解合理的是_________________。
A.含氧酸中氧原子总数越多,酸性越强
B.同种元素化合价越高,对应含氧酸的酸性越强
C.HNO3中氮元素的正电性更高,在水溶液中更易电离出H+,酸性强于HNO2
(4)磷化硬(BP)是一种超硬耐磨涂层材料,其晶胞结构如图所示,图中a点和b点的原子坐标参数依次为(0,0,0)、(![]() ,
, ![]() ,
, ![]() ),则c 点的原子坐标参数为_______。已知该晶体密度为ρg·cm-3,则B-P键的键长为_____pm (阿伏加德罗常数用NA表示,列出计算式即可)。
),则c 点的原子坐标参数为_______。已知该晶体密度为ρg·cm-3,则B-P键的键长为_____pm (阿伏加德罗常数用NA表示,列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000mol/L 盐酸滴入20.00mL1.000 mol/L 氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。
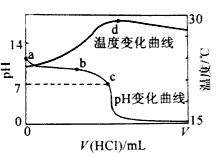
下列有关说法不正确的是( )
A. a 点由水电离出的c(H+)>1.0×10-14mol/L
B. b 点: c(NH4+)>c(Cl-)
C. c 点: c(Cl-)=c(NH4+)
D. d 点后,溶液温度略下降的主要原因是NH3·H2O 电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.双氧水(主要成分H2O2)是常见的氧化剂、还原剂。
(1)如下图是工业上制备过氧化氢最常见的方法,写出实际发生反应的总方程式____________。

(2)H2O2可看作二元弱酸,写出它在水中第一步电离的方程式______________________________。
II.A、B、C、D、E、X是中学常见的无机物,存在如下图转化关系(部分生成物和反应条件略去)。

(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:__________________________________________________________________________________。
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则X可能为______________________(填代号)。
a.NaHCO3 b.Na2CO3 c.Fe(OH)3 d.Na[Al(OH)4]
(3)若A为淡黄色粉末,则A的电子式为____________________。若X为一种最常见的造成温室效应的气体。则鉴别等浓度的D、E两种溶液,可选择的试剂为__________(填代号)。
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Ca(OH)2溶液
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红。则A与H2O反应的化学反应方程式为________________________________,E是__________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com