
【题目】2011年,麻省理工学院科研团队研发出一种人造树叶,它将一片半导体材料夹在两层特殊的催化剂的中间。若将人造树叶整体浸泡在溶液中,当光照在人造树叶上,就会分解水生成H2和O2,结构如图所示。下列有关人造树叶说法正确的是

A. 该装置最终将太阳能转变为电能
B. Ni、Mo、Zn基催化剂极为阳极,发生氧化反应
C. 可以将人造树叶浸泡在碱性溶液中
D. 钴基催化剂上发生反应:2H2O-4e-=4H++O2↑
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】下列判断中一定正确的是( )
A. NaCl及Na2O2固体中阴、阳离子数之比均为1:1
B. 等质量的O2与O3中,氧原子的个数比为3:2
C. 分别用H2O2、KMnO4分解制O2,当制得等质量O2时,转移电子数之比为1:2
D. 10 mL 0.3 mol·L-1 NaCl溶液与30 mL 0.1 mol·L-1 AlCl3溶液中Cl -物质的量浓度比为1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块镁铝合金投入到过量的1 mol·L-1盐酸中,待合金完全溶解后,再往溶液里加入1 mol·L-1NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示,下列说法中错误的是( )
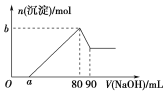
A. 盐酸的体积为90 mL
B. a的取值范围为0<a<50
C. n(Mg2+)<0.025 mol
D. 当a值为30时,b值为0.02
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度和有催化剂条件下,恒容密闭容器中发生反应N2+3H2 2NH3,下列说法正确的是( )
t/min | 0 | 5 | 10 | 15 | 20 |
c(NH3)/(mol·L-1) | 0 | 1.00 | 1.60 | 1.80 | 1.80 |
A. 0~10min内,v(NH3)=0.16mol·L-1·min-1 B. 0~10min内,v(N2)=0.18mol·L-1·min-1
C. 0~10min内,v(N2)=0.16mol·L-1·min-1 D. 15~20min内,反应v(N2)正= v(N2)逆=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺(CH3NH2) 的性质与氨相似。25℃时,向10mL1.0000mol·L-1甲胺溶液中滴入0.5000mol·L-1的稀硫酸,溶液的pOH 与所加稀硫酸的体积(V)关系如图所示。
已知:pOH=-lgc(OH-),Kb(CH3NH2·H2O)=4.0×10-4。下列说法正确的是( )
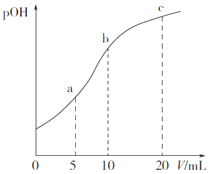
A. pOH=7 时,2c(CH3NH3+)=c(SO42-)
B. 水的电离程度:c>b>a
C. a点溶液中存在:c(CH3NH2·H2O)>c(CH3NH3+)>c(H+)>c(OH-)
D. 25℃时1.000 mol·L-1甲胺溶液中CH3NH2·H2O的电离度约为2.0%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为—285.8kJ·mol-1、—283.0kJ·mol-1和—726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_______________________________________________________;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考查温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
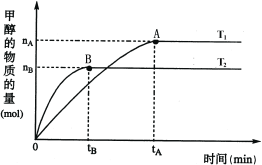
下列说法正确的是________(填序号)
a.温度为T1时,从反应开始到平衡,生成甲醇的平均速率为:v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
b.T1> T2
c.该反应为放热反应
d.处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
(4)在T1温度时,将1molCO2和3molH2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为α, 则容器内的压强与起始压强之比为_______________________;
(5)在直接以甲醇为燃料的电池中,电解质溶液为碱性,负极的反应式为________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp (CaCO3)=2.8×10-9 Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是
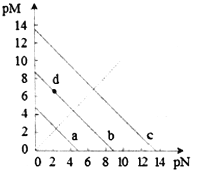
A. a线是CaSO4沉定溶解平衡曲线
B. T℃时,向10mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+)∶c(Pb2+)=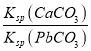
C. d点表示CaCO3的饱和溶液。且c(Ca2+)<c(CO32-)
D. T℃时,向CaSO4沉淀中加入1mol·L-1的Na2CO3溶液,CaSO4沉淀会转化为CaCO3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是( )
A. 紫色石蕊试液遇酸变为红色
B. 使用铁触媒,可加快合成氨反应速率
C. 合成氨工业采用500℃的高温进行生产
D. 一定条件下2HI(g) ![]() H2(g)+I2(g)达平衡后,压缩体系的容器,颜色迅速变深
H2(g)+I2(g)达平衡后,压缩体系的容器,颜色迅速变深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com