
【题目】下列判断中一定正确的是( )
A. NaCl及Na2O2固体中阴、阳离子数之比均为1:1
B. 等质量的O2与O3中,氧原子的个数比为3:2
C. 分别用H2O2、KMnO4分解制O2,当制得等质量O2时,转移电子数之比为1:2
D. 10 mL 0.3 mol·L-1 NaCl溶液与30 mL 0.1 mol·L-1 AlCl3溶液中Cl -物质的量浓度比为1:3
科目:高中化学 来源: 题型:
【题目】某研究小组将V1mL 1.0mol/LHCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。回答下列问题:
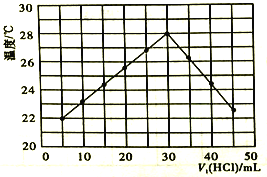
(1)研究小组做该实验时环境温度______(填“高于”、“低于”或“等于”)22℃,该反应是______热反应。
(2)由题干及图形可知,![]() _____时,酸碱恰好完全中和,此反应所用Na0H溶液的浓度应为______mol/L。
_____时,酸碱恰好完全中和,此反应所用Na0H溶液的浓度应为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答氯碱工业中的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k= (要求写出计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是 (填序号);
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
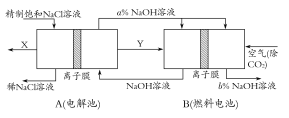
①图中X、Y分别是 、 (填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小 ;
②分别写出燃料电池B中正极、负极上发生的电极反应,正极: ;负极: ;
③这样设计的主要节(电)能之处在于(写出2处) 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质分类的依据通常有组成和性质,下列物质分类中,只考虑组成的是( )
A.Na2SO4是钠盐、硫酸盐、正盐
B.HNO3是一元酸、强酸、挥发性酸
C.Mg(OH) 2是二元碱、难溶性碱、中强碱
D.Al2O3是两性氧化物、金属氧化物、最高价氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作或叙述正确的是( )
① 医院用银氨溶液检验某病人是否患糖尿病
② 乙酸乙酯中的少量乙酸可用饱和![]() 溶液除去
溶液除去
③ 淀粉水解时应用浓硫酸作催化剂
④ 在鸡蛋白溶液中滴入浓![]() ,微热会产生黄色物质
,微热会产生黄色物质
⑤ 在植物油中滴入溴水,溴水褪色
⑥ 用盐析法可分离和提纯蛋白质
A.①②③④ B.②④⑤⑥
C.①③⑤⑥ D.①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)氧化为1mol SO3(g)的ΔH= —99kJ/mol。
2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)氧化为1mol SO3(g)的ΔH= —99kJ/mol。

请回答下列问题:
(1)图中A点表示: ;图中C点表示: ;
(2)写出 SO3(g)分解成SO2(g)和O2(g)的热化学方程式 ;
(3)能量E在一定条件下可以降低,这种条件是: ;
(4)SO3溶于水可生成H2SO4 ,化学方程式为 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气极其相关产品在生产生活中应用广泛。
(1)氯气属于有毒气体,贮氯罐意外泄漏时,消防员会喷洒稀氢氧化钠溶液,其作用是__________。(用化学方程式表示)。
实验室常用NaOH溶液吸收多余的氯气,下列也可用于吸收氯气的是_________(填字母)。
a.NaCl溶液 b.FeSO4溶液 c.KMnO4溶液
(2)家庭中常用消毒液(主要成分NaClO)、洁厕灵(主要成分盐酸)等清洁卫生。某品牌消毒液包装上的说明如下图。

①分析“对金属制品有腐蚀作用”的原因:_______________。
②需“密闭保存”的原因:______________。
③“与洁厕灵同时使用”会产生有毒的氯气,请写出反应的离子方程式_____________。
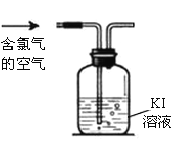
(3)已知空气中氯气含量超过0.1mg/m3就会引起中毒。某液氯生产车间在一次测定空气中氯气的含量时,测得消耗0.001ml/L Kl溶液100mL,为了判断空气中氯气的含量是否超标,还需要获得的数据是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中既含有离子键又含有共价键的是( )
A. NaOH、H2O、NH4Cl B. KOH、Na2O2、(NH4)2S
C. H2O2 、MgO、Na2SO4 D. CaBr2 、HCl、 MgCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com