
����Ŀ����ȸʯ����Ҫ�ɷ�ΪCu2(OH)2CO3����������Fe��Si�Ļ����ʵ�����Կ�ȸʯΪԭ���Ʊ�CuCl2��3H2O��CaCO3�IJ������£�
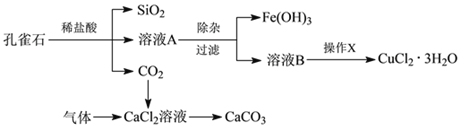
Ϊ����й����⣬��ȤС��ͬѧ����й����ʳ�����pH�������£�
���� | pH (��ʼ����) | pH(��ȫ����) |
Fe(OH)3 | 1.9 | 3.2 |
Fe(OH)2 | 7.0 | 9.0 |
Cu(OH)2 | 4.7 | 6.7 |
��1���ڳ��ӹ���ʱΪ�˳�ȥFe2+����������ɫ��������ʹFe2+����ΪFe3+���˹����漰�����ӷ���ʽΪ________��
��2��Ȼ���ټ����ʵ����ʵ�����Һ��pH��_________ (��д��Χ)��ʹFe3+ת��ΪFe(OH)3�����Դﵽ��ȥFe3+��������ҺpH����ѡ�������е�________��
A.NaOH B.NH3��H2O C.CuO D.Cu(OH)2
��3������Fe(OH)3�Ƿ������ȫ��ʵ�鷽����________________________��
��4������X����________��________�����˺�ϴ�ӵȡ�CuCl2��3H2O�������յ����ղ���Ļ�ѧʽ�� ______________��
��5��ij��θҩƬ�������ΪCaCO3����ҩƬ��CaCO3���������IJⶨ�������£�
a������0.1mol��L��1��HCl��Һ��0.1mol��L��1��NaOH��Һ��250mL��
b��ȡ0.6gĥ����θҩ����ƿ�С�
c������ƿ�ڼ���25.00mL 0.1 mol��L��1��HCl��Һ��
d���Է�̪Ϊָʾ������0.1mol��L��1��NaOH��Һ�ζ������ﵽ�ζ��յ㡣
e���ظ�bcd�����IJ���2�Ρ�
�ٶ���ʱ�����ζ�ǰƽ�ӣ��ζ������ӣ�������CaCO3������������________(ѡ����ƫ��������ƫС��������Ӱ����)��
�����ζ���NaOH��Һ��ƽ������Ϊ15.00mL����θҩ��̼��Ƶ���������Ϊ_______��
���𰸡� H2O2+2Fe2++2H+ =2Fe3++2H2O 3.2��4.7 AB ȡ�����ϲ���Һ���μ�KSCN��Һ����������Ѫ��ɫ������Fe(OH)3������ȫ ����Ũ�� ��ȴ�ᾧ CuO ƫС 8.3��
����������1����ɫ�������ǹ������⣬�����������������ӵķ���ʽΪH2O2+2Fe2++2H+ =2Fe3++2H2O��
��2������pHӦ�ý������Ӷ�ת��Ϊ������������������Ӧ�ô���3.2������ͬʱ���ܳ���������ͭ������Ӧ��С��4.7��ʹ���������ƻ�ˮ����pH�����������ڹ���ʹ��Һ�е�ͭ����ת��Ϊ������ͭ����������AB����ѡ����CuO��Cu(OH)2��������ˮ��ֱ�Ӽӹ���Ҳ����ʹͭ���ӳ���������CD���ǿ���ѡ��ġ�
��3������Fe(OH)3�Ƿ������ȫ��ʵ�鷽���Ǿ��Ǽ�����Һ���Ƿ��������ӣ�����Ϊ�������ϲ���Һ���μ�KSCN��Һ����������Ѫ��ɫ������Fe(OH)3������ȫ��
��4��Ϊ�˱�֤�ܵõ����нᾧˮ���Σ�ͬʱ������С�Ȼ�ͭ��ˮ�⣬ˮ��ҺӦ�þ�������Ũ������ȴ�ᾧ������ϴ�ӣ�����õ����壨��ѡ�����ɵ���Ҫ�����ǣ����ɹ�����ͭ���ӿ���ˮ�⣬���ҿ���ʧȥ�ᾧˮ����CuCl2��3H2O��������ʱ������ͭ���ӵ�ˮ�⣬�����ղ���ΪCuO��
��5���ٶ���ʱ�����ζ�ǰƽ�ӣ��ζ������ӣ��������ƫ���������ᷴӦ��������������ˣ�Ҳ�ͽ���̼��Ʒ�Ӧ��ʣ�����������ˡ���Ϊ��������������Ƕ�ֵ�����Խ���̼��Ʒ�Ӧ�����������ˣ�Ҳ�ͽ�̼��������ˣ�����CaCO3������������ƫС��
�ڵζ���NaOH��Һ��ƽ������Ϊ15.00mL������������Ϊ0.015��0.1=0.0015mol�������к͵�����Ϊ0.0015mol��������̼��Ʒ�Ӧ������Ϊ��0.025��0.1��0.0015=0.001mol������̼���Ϊ0.0005mol������Ϊ0.05g����������Ϊ0.05��0.6=8.3%��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij��ɫ��Һ�л����ص���NaOH��Һֱ����������������������������NaOH��Һ ����Ĺ�ϵ��ͼ��ʾ���ɴ�ȷ����ԭ��Һ�к��е��������ǣ�������
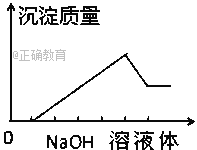
A. Mg2+��Al3+��Fe2+ B. H+��Mg2+��Al3+
C. H+��Ba2+��Al3+ D. ֻ��Mg2+��Al3+
���𰸡�B
������������ͼ���Կ�����Ϊ4���Σ���һ���������ڶ��γ����������ൽ��������������в��ֳ����ܺ��������Ƽ�����Ӧ�������ֳ����ܽ⣬���Ľγ����������������������������������������һ��������˵��ˮ��Һ��һ�����������ӣ���AD���������в��ֳ����ܺ��������Ƽ�����Ӧ��˵�����ֳ���������������ԭ��Һ��һ�����������ӣ����Ľγ�����������������������������������ӣ�˵��һ����һ�ֳ������������Ʋ���Ӧ������֪�ó�����������þ��ԭ��Һ��һ������þ���ӣ�ͭ��������ɫ������Һ��ɫ��������B��ȷ��C����ѡB��
�����͡���ѡ��
��������
14
����Ŀ�����������۷���FeCl3��Һ�У���ȫ��Ӧ����Һ�е�Fe2����Fe3��Ũ����ȣ����ѷ�Ӧ��Fe3����δ��Ӧ��Fe3�������ʵ���֮����( )
A. 2��3 B. 3��2
C. 1��2 D. 1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽��FeSO4��Cu(NO3)2�Ļ�����и���ֵĺ�����������������̣�

��������������ȷ���ǣ� ��
A. n=0.02 B. V=2240
C. m=3.2 D. ԭ�������FeSO4����������ԼΪ89%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ����ա�
��1������Ǧ���ص���Ȼ�����Һ�����ڳ��ʱ������ӦΪ____���ŵ����ɵĹ���ḽ���ڵ缫���棬������������������������96gʱ�������ϵ�·��ת�Ƶĵ�����Ϊ____��
��2��CO��H2һ�������·�Ӧ���ɼ״���CH3OH�����״���һ��ȼ�ϣ������ü״����һ��ȼ�ϵ�أ���ϡ�������������Һ�����ʯī���缫���õ�ظ�����ӦʽΪ_______��
��3��ijʵ��С��ͬѧ�Ե绯ѧԭ��������һϵ��̽�����
����ͼ1Ϊijʵ��С������������ԭ��Ӧ��(�����ӷ���ʽ��ʾ)_____��Ƶ�ԭ���װ��

�������������䣬�������Ż�����ͭ������ʯī������n�ͣ���ͼ2��ʾ��
�ڼ�װ����ͭ�缫��ӦΪ_______________����װ����ʯī(1)Ϊ________��(��������������������������������)����װ������ͭ˿����ʯī�缫�Ϸ����ķ�ӦʽΪ_________________.
��ij����������ͼ3��ʾװ�ã�̽��NO2��O2��������N2O5�γ�ԭ��صĹ��̣��õ�ص�������ӦʽӦΪ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ����ѡ���װ�û�����(�г�װ������ȥ)��ȷ����
ѡ�� | A | B | C | D |
ʵ�� | ��CCl4��ȡ��ˮ�е�Br2 | ��ʳ��ˮ����ȡNaCl���� | ��KI��I2�Ĺ��������л���I2 | ����100 mL 0.100 0 mol��L-1 K2Cr2O7��Һ |
װ�û����� |
|
|
|
|
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӵ�������ֵΪNA������˵������ȷ���ǣ� ��
A. 5NH4NO3 ![]() 2HNO3��4N2����9H2O��Ӧ�У�����28 g N2��ת�Ƶĵ�����ĿΪ3.75NA
2HNO3��4N2����9H2O��Ӧ�У�����28 g N2��ת�Ƶĵ�����ĿΪ3.75NA
B. ���³�ѹ�£�agij���庬������Ϊb����cg����������Ϊ![]()
C. 2mol/L��CaCl2��Һ��Cl-����ĿΪ4NA
D. 46g NO2��N2O4�Ļ�������к��е���ԭ�Ӹ���Ϊ3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������γ�����⻯ѧ������������Ⱦ������ȼú�ͻ�����β���ǵ����������Ҫ��Դ�����ڶ����е�һЩ���������һ�����о���
��1����CH4����ԭ��������������������������Ⱦ��
��֪����CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ��H= 574 kJ��moll
4NO(g)+CO2(g)+2H2O(g) ��H= 574 kJ��moll
��CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) ��H= 1160 kJ��moll
2N2(g)+CO2(g)+2H2O(g) ��H= 1160 kJ��moll
д��CH4(g)��NO2(g)��Ӧ����N2(g)��CO2(g)��H2O(g)���Ȼ�ѧ����ʽ______________________________________________________��
��2��������β�������ܿڲ��ô�����NO��COת��������Ⱦ���塣T��ʱ���������ʵ�����NO��CO�����ݻ�Ϊ2 L���ܱ������У������¶Ⱥ�������䣬��һ�������·�����Ӧ����Ӧ������NO�����ʵ�����ʱ��仯��ͼ��ʾ��
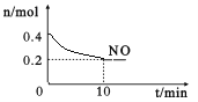
��д���÷�Ӧ�Ļ�ѧ����ʽ______________________________________��
��10 min�ڸ÷�Ӧ������v(CO)=__________________��T��ʱ���û�ѧ��Ӧ��ƽ�ⳣ��K=_______��
�����÷�Ӧ��H��0���ں��ݵ��ܱ������У���Ӧ��ƽ��ı�ijһ����������ʾ��ͼ��ȷ����____________��������ţ�
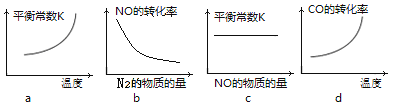
��һ���¶��£��ں����ܱ������г���һ����NO��CO���и÷�Ӧ������ѡ�����жϷ�Ӧ�Ѵﵽ��ѧƽ��״̬����____________��
a.������ѹǿ���ٱ仯 b.CO2��Ũ�Ȳ��ٱ仯
c.2v��(NO)=v��(N2) d.������ܶȲ��ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����̿����Ҫ�ɷ���MnO2��������������������þ������п��ͭ�Ļ���������ʡ����������Ҫ�ɷ���FeS2�������й衢��������������ʡ���ҵ�������̿��Ʊ�̼���̲���������泥�����Ҫ�������£�

��֪�������Ӵӿ�ʼ�γ��������������������ʱ��Һ��pH���±���
�������� | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
��ʼ����pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
��ȫ����pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
��1����߽����ʵĿɲ�ȡ�Ĵ�ʩ��____��
a.�ʵ������¶� b.���� c.���������� d.��ѹ
��2����ȡ��ɺ�ȡ��ȡҺ����������KSCN��Һ�������������ȡʱ��������Ҫ��Ӧ�Ļ�ѧ����ʽ��__________________________��
��3������pHΪ5.4��5.8��Ŀ����______________��
��4������3����Ҫ�ɷֵĻ�ѧʽ��_______��
��5������50��̼����ԭ����_________________________________���ù��̷�����Ӧ�����ӷ���ʽ��__________________��
��6������̼���̲�Ʒ��ȫϴ���ķ�����_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС���Ʊ������Ĺ������£�
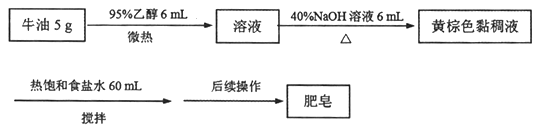
��ش�
��1�������Ҵ���Ŀ����________;������������ָ________��
��2��֤��ţ���ѷ�Ӧ��ȫ�ķ�����________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com