
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液 体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )
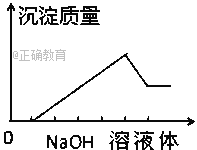
A. Mg2+、Al3+、Fe2+ B. H+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. 只有Mg2+、Al3+
【答案】B
【解析】根据图像,可以看出分为4个阶段:第一阶段无沉淀,第二阶段沉淀量逐渐增多到最大量,第三阶段有部分沉淀能和氢氧化钠继续反应,即部分沉淀溶解,第四阶段沉淀的量不再随着氢氧化钠量的增多而增加。第一阶段无沉淀,说明水溶液中一定含有氢离子,故AD错误,第三阶段有部分沉淀能和氢氧化钠继续反应,说明部分沉淀是氢氧化铝,原溶液中一定含有铝离子,第四阶段沉淀的量不再随着氢氧化钠量的增多而增加,说明一定有一种沉淀和氢氧化钠不反应,可推知该沉淀是氢氧化镁,原溶液中一定含有镁离子,铜离子有颜色,与溶液无色不符,故B正确,C错误;故选B。
【题型】单选题
【结束】
14
【题目】将适量铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe2+和Fe3+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是( )
A. 2∶3 B. 3∶2
C. 1∶2 D. 1∶1
科目:高中化学 来源: 题型:
【题目】过量的锌粉与一定量的稀盐酸反应,为了加快反应速率,但是又不影响生成的氢气总量,可以采取的措施是
A.加入适量的水B.加入氯化钠溶液
C.加入少量CuSO4溶液D.加入等体积的浓度较大的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种优良的消毒剂,常将其制成NaClO2固体,以便运输和贮存,过氧化氢法备NaClO2固体的实验装置如图所示。
已知:①2NaC1O3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②ClO2熔点-59℃、沸点11℃,浓度过高时易发生分解;③H2O2沸点150℃
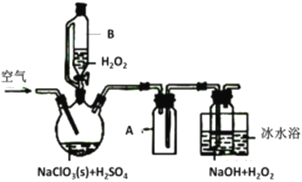
请回答:
(1)仪器B的作用是__________________,仪器A的作用是_________________,冰水浴冷却的目的是____________________(写两种)。
(2)该装置不完善的方面是________________________。
(3)空气流速过快或过慢,均降低NaClO产率,试解释其原因________________________。
(4)Cl-存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步完成,请将其补充完整:①_____________________________(用离子方程式表示),②H2O2+Cl2=2Cl-+O2+2H+
(5)NaClO2纯度测定:①准确称取所得NaClO2样品10.0g于烧杯中,加入适量蒸馏水过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的产物为Cl-),将所得混合液配成250mL待测溶液;②取25.00mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为__________________________,重复滴定3次,测得Na2S2O3标准液平均用量为20.00mL,则该样品中NaClO2的质量分数为____________________。(M(NaClO2)=90.5g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取50.0mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51g白色沉淀,用 过量稀硝酸处理后沉淀量减少到4.66g,并有气体放出。试计算:
(1)原混合溶液中Na2CO3和Na2SO4的物质的量浓度_______________;
(2)产生的气体在标准状况下的体积_____________。(要有过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硝酸锶Sr(NO3)2可用于制造信号灯,光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:

已知:①“滤渣1”的成份为Ba(NO3)2、Sr(NO3)2 ②铬酸(H2CrO4)为弱酸
(1)“酸浸”不能采用高温的原因是__________________,“滤液1”的主要溶质是_____________________。
(2)相对于水洗,用浓HNO3洗涤的优点是_____________________。
(3)“滤液2”中过量的H2CrO4被N2H4还原为Cr3+,同时放出无污染的气体,写出发生反应的离子方程式:_____________________________________________________。
(4)已知Cr(OH)3类似氢氧化铝,还原后溶液的pH不能大于8的原因是(结合离子方程式说明理由)_______________________________________________________。
(5)为了测定“滤渣2”中BaCrO4的含量,进行以下实验:
+mg“滤渣2” 溶液
溶液![]() 滴定终点时消耗VmLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)
滴定终点时消耗VmLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)
①“滤渣2”中BaCrO4(摩尔质量为Mg/mol)的质量分数为__________(用代数式表示)。
②若加入的HI溶液过量太多,测定结果会_______(“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.花生油的主要成分是高级脂肪酸甘油酯,属于高分子化合物
B.汽油和食用油都可以在碱性条件下水解
C.脱脂棉、滤纸的主要成分均为纤维素,完全水解能得到葡萄糖
D.钠与乙醇反应时钠浮在液面上,反应比钠与水反应更剧烈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3·xH2O、Fe2O3、SiO2等)提取纯Al2O3作冶炼铝的原料,提取时操作过程如图,指出图中操作错误的是( )

A. ④⑤ B. ③④
C. ②⑤ D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修5:有机化学基础]
甲苯在医药、农药,特别是香料合成中应用广泛,可合成以下物质:
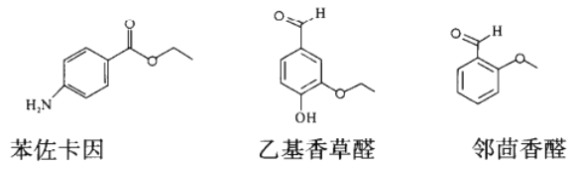
(1)苯佐卡因中含有的碱性官能团为____________(填名称)。
(2)乙基香草醛和邻茴香醛具有相同的亲水基团,该基团可用________(填物理方法)检测。
(3)写出符合下列条件的乙基香草醛的同分异构体的结构简式______(任写两种)。
a.苯环上连接两个互为对位的基团 b.有一个-CH3
c.与FeCl3溶液发生显色反应 d.能发生水解反应
(4)已知:
有机物M为含有两个互为邻位基团的芳香族化合物,且与本佐卡因互为同分异构,其合成路线如下:
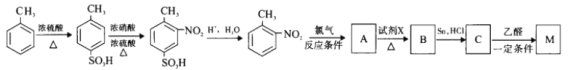
①生成A的“反应条件”为________;
②以上合成路线涉及的7个反应中,属于取代反应的有_________个;
③M的结构简式为___________;
④A→B反应的化学方程式为____________。
(5)参照上述合成路线,以甲苯和甲醇为原料(无机试剂任选),设计制备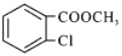 的合成路线___________。
的合成路线___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuCl2·3H2O及CaCO3的步骤如下:
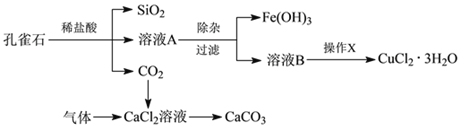
为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
物质 | pH (开始沉淀) | pH(完全沉淀) |
Fe(OH)3 | 1.9 | 3.2 |
Fe(OH)2 | 7.0 | 9.0 |
Cu(OH)2 | 4.7 | 6.7 |
(1)在除杂过程时为了除去Fe2+,常加入绿色氧化剂,使Fe2+氧化为Fe3+,此过程涉及的离子方程式为________。
(2)然后再加入适当物质调节溶液的pH至_________ (填写范围),使Fe3+转化为Fe(OH)3,可以达到除去Fe3+,调整溶液pH不可选用下列中的________。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(3)检验Fe(OH)3是否沉淀完全的实验方案是________________________。
(4)操作X包括________、________、过滤和洗涤等。CuCl2·3H2O加热灼烧的最终产物的化学式是 ______________。
(5)某种胃药片的治酸剂为CaCO3,该药片中CaCO3质量分数的测定步骤如下:
a.配制0.1mol·L-1的HCl溶液和0.1mol·L-1的NaOH溶液各250mL。
b.取0.6g磨碎后的胃药于锥形瓶中。
c.向锥形瓶内加入25.00mL 0.1 mol·L-1的HCl溶液。
d.以酚酞为指示剂,用0.1mol·L-1的NaOH溶液滴定,至达到滴定终点。
e.重复bcd三步的操作2次。
①读数时,若滴定前平视,滴定后仰视,则所测CaCO3的质量分数将________(选填“偏大”、“偏小”或“无影响”)。
②若滴定中NaOH溶液的平均用量为15.00mL,则胃药中碳酸钙的质量分数为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com