
【题目】工业上用铝土矿(主要成分为Al2O3·xH2O、Fe2O3、SiO2等)提取纯Al2O3作冶炼铝的原料,提取时操作过程如图,指出图中操作错误的是( )

A. ④⑤ B. ③④
C. ②⑤ D. ①②
科目:高中化学 来源: 题型:
【题目】如图装置中,在U形管底部盛有CCl4,分别在U形管两端小心倒入饱和食盐水和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述中错误的是

A. 铁丝在两处的腐蚀速率:a < b
B. a、b两处相同的电极反应式为Fe-2e-==Fe2+
C. 一段时间后,a处液面高于b处液面
D. 生铁丝中的碳在a、b两处分别作原电池的负极和正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于(NH4)2SO4溶液,下列说法正确的是
A. 溶液中存在电离平衡:(NH4)2SO4![]() 2NH4++SO42-
2NH4++SO42-
B. 向溶液中滴加少量浓硫酸,c(NH4+)与c(SO42-)均增大
C. 加水稀释,溶液中所有离子的浓度均减小
D. 溶液中:c(SO42-)=2c(NH4+)+2c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液 体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )
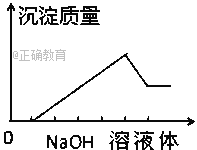
A. Mg2+、Al3+、Fe2+ B. H+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. 只有Mg2+、Al3+
【答案】B
【解析】根据图像,可以看出分为4个阶段:第一阶段无沉淀,第二阶段沉淀量逐渐增多到最大量,第三阶段有部分沉淀能和氢氧化钠继续反应,即部分沉淀溶解,第四阶段沉淀的量不再随着氢氧化钠量的增多而增加。第一阶段无沉淀,说明水溶液中一定含有氢离子,故AD错误,第三阶段有部分沉淀能和氢氧化钠继续反应,说明部分沉淀是氢氧化铝,原溶液中一定含有铝离子,第四阶段沉淀的量不再随着氢氧化钠量的增多而增加,说明一定有一种沉淀和氢氧化钠不反应,可推知该沉淀是氢氧化镁,原溶液中一定含有镁离子,铜离子有颜色,与溶液无色不符,故B正确,C错误;故选B。
【题型】单选题
【结束】
14
【题目】将适量铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe2+和Fe3+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是( )
A. 2∶3 B. 3∶2
C. 1∶2 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(1)25 ℃时,等浓度的三种溶液(a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液)的pH由大到小的顺序为________________________________。(填写序号)
(2)25 ℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_____________________。
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是 _______。
A.c(H+)>c(OH-) B. c(H+)<c(OH-)
C.c(H+)+c(HCN) = C(OH-) D.c(HCN)+c(CN-)=0.01mol/L
(4)常温下,将某一元酸HA 和NaOH 溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH 如下表:
实验编号 | HA物质的量浓度(molL-1) | NaOH物质的量浓度(molL-1) | 混合溶液的pH |
a | 0.1 | 0.1 | pH=9 |
b | c | 0.2 | pH=7 |
请回答:
①从a组情况分析, HA是强酸还是弱酸_____________。
②b组情况表明,c_______0.2(选填“大于”“小于”或“等于”)。混合溶液中离子浓度c(A-)________ c(Na+)(选填“大于”“小于”或“等于”)。
③a组实验所得混合溶液中由水电离出的c(OH-)=______molL-1.写出该混合溶液中下列算式的精确结果(不需做近似计算).c(Na+)-c(A-)=______molL-1 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.含有少量氯化钠的硝酸钾粉末,可采用冷却热饱和溶液的结晶法进行提纯
B.实验室中少量金属钠常保存在煤油中,实验时多余的钠不能放回原试剂瓶中
C.铁丝能代替铂丝做焰色反应实验
D.苯不能用带橡胶塞的试剂瓶贮存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见物质之间的转化如下图所示:
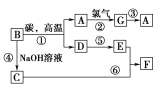
其中B常被用于制造光导纤维,其对应的单质的结构与金刚石的结构是相似的;C、F均含有A物质所含元素;反应中生成的水及次要产物均已略去。
(1)试推测:A________,C________,F________。(写化学式)
(2)试写出反应⑥的离子方程式:_________________________。
(3)在反应①中,碳的作用是____________________,当生成1 mol A时,转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究FeSO4和Cu(NO3)2的混合物中各组分的含量,现设计如下流程:

下列叙述中不正确的是( )
A. n=0.02 B. V=2240
C. m=3.2 D. 原混合物中FeSO4的质量分数约为89%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物能形成酸雨和光化学烟雾,严重污染环境。燃煤和机动车尾气是氮氧化物的主要来源。现在对其中的一些气体进行了一定的研究:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) △H= 574 kJ·moll
4NO(g)+CO2(g)+2H2O(g) △H= 574 kJ·moll
②CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) △H= 1160 kJ·moll
2N2(g)+CO2(g)+2H2O(g) △H= 1160 kJ·moll
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式______________________________________________________。
(2)在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体。T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,在一定条件下发生反应,反应过程中NO的物质的量随时间变化如图所示。
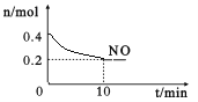
①写出该反应的化学方程式______________________________________。
②10 min内该反应的速率v(CO)=__________________;T℃时,该化学反应的平衡常数K=_______。
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____________。(填序号)
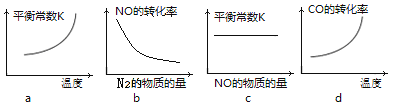
④一定温度下,在恒容密闭容器中充入一定量NO和CO进行该反应,下列选项能判断反应已达到化学平衡状态的是____________。
a.容器中压强不再变化 b.CO2的浓度不再变化
c.2v正(NO)=v逆(N2) d.气体的密度不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com