
【题目】常见物质之间的转化如下图所示:
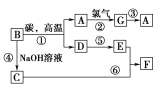
其中B常被用于制造光导纤维,其对应的单质的结构与金刚石的结构是相似的;C、F均含有A物质所含元素;反应中生成的水及次要产物均已略去。
(1)试推测:A________,C________,F________。(写化学式)
(2)试写出反应⑥的离子方程式:_________________________。
(3)在反应①中,碳的作用是____________________,当生成1 mol A时,转移电子的物质的量为________。
【答案】Si Na2SiO3 H2SiO3 SiO32-+CO2+H2O===CO32-+H2SiO3↓(或SiO32-+2CO2+2H2O===2HCO3-+H2SiO3↓) 作还原剂 4 mol
【解析】
B常被用于制造光导纤维,B是二氧化硅,其对应的单质的结构与金刚石的结构是相似的,二氧化硅高温下与碳反应生成CO和Si,则D是CO,A是硅,与氯气反应生成G是四氯化硅,四氯化硅被还原转化为硅。C、F均含有A物质所含元素,反应中生成的水及次要产物均已略去,因此B与氢氧化钠溶液反应生成的C是硅酸钠,硅酸钠与E反应生成F,则E是二氧化碳,F是硅酸沉淀,据此解答。
根据以上分析可知A是硅,B是二氧化硅,C是硅酸钠,D是CO,E是二氧化碳,F是硅酸,G是四氯化硅,则
(1)A、C、F的化学式分别是Si、Na2SiO3、H2SiO3;
(2)根据以上分析可知反应⑥的离子方程式为SiO32-+CO2+H2O=CO32-+H2SiO3↓或SiO32-+2CO2+2H2O=2HCO3-+H2SiO3↓;
(3)反应①的方程式为SiO2+2C![]() Si+2CO↑,碳元素化合价升高,失去电子,碳的作用是作还原剂。Si元素化合价从+4价降低到0价,因此当生成1 mol A时,转移电子的物质的量为4 mol。
Si+2CO↑,碳元素化合价升高,失去电子,碳的作用是作还原剂。Si元素化合价从+4价降低到0价,因此当生成1 mol A时,转移电子的物质的量为4 mol。


科目:高中化学 来源: 题型:
【题目】高纯硝酸锶Sr(NO3)2可用于制造信号灯,光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:

已知:①“滤渣1”的成份为Ba(NO3)2、Sr(NO3)2 ②铬酸(H2CrO4)为弱酸
(1)“酸浸”不能采用高温的原因是__________________,“滤液1”的主要溶质是_____________________。
(2)相对于水洗,用浓HNO3洗涤的优点是_____________________。
(3)“滤液2”中过量的H2CrO4被N2H4还原为Cr3+,同时放出无污染的气体,写出发生反应的离子方程式:_____________________________________________________。
(4)已知Cr(OH)3类似氢氧化铝,还原后溶液的pH不能大于8的原因是(结合离子方程式说明理由)_______________________________________________________。
(5)为了测定“滤渣2”中BaCrO4的含量,进行以下实验:
+mg“滤渣2” 溶液
溶液![]() 滴定终点时消耗VmLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)
滴定终点时消耗VmLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)
①“滤渣2”中BaCrO4(摩尔质量为Mg/mol)的质量分数为__________(用代数式表示)。
②若加入的HI溶液过量太多,测定结果会_______(“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3·xH2O、Fe2O3、SiO2等)提取纯Al2O3作冶炼铝的原料,提取时操作过程如图,指出图中操作错误的是( )

A. ④⑤ B. ③④
C. ②⑤ D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿的主要成分是MnO2,其悬浊液可吸收烟气中SO2,所得酸性浸出液又可用于制备高纯硫酸锰,其一种工艺流程如图所示。回答下列问题:

(1)软锰矿悬浊液吸收SO2的过程中,SO2体现了________性。
(2)“氧化剂”发生反应的离子方程式为____________。
(3)已知:Ksp[Al(OH) 3]=1.0×10-34;
Krp[Fe(OH) 3]=2.6×10-30;
Krp[Ni(OH) 2]=1.6×10-15;
Krp[Mn(OH) 2]=4.0×10-14;
“水解沉淀“中:
①“中和剂“可以是________(填标号)
A.Al2O3 B.H2SO4 C.MgO D.MnO2
②溶液的pH应不低于________(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全)
③不采用“水解沉淀“除Ni2+的原因是___________。
(4)“置换”中发生反应的离子方程式为____________。
(5)“结品分离”中的部分物质的溶解度曲线如图。

①加入稀硫酸的作用是(结合平衡移动原理解释)_____________。
②结晶与过滤过程中,体系温度均应维持在_______℃(填“27”、“60”或“70”)。
(6)高纯硫酸锰可用于水中溶解氧含量的测定,步骤如下:
步骤1:水中的氧气在碱性溶液中将MnSO4氧化为MnO(OH)2。
步骤2:在酸性条件下,加入KI将生成的MnO(OH)2再还原成Mn2+。
步骤3:用Na2S2O3标准溶液滴定步骤2中生成的I2(2S2O32-+I2=2I-+S4O62-)。
取某水样100mL,按上述测定步骤滴定,消耗a mol·L-1 NaS2O3标准溶液VmL,该水样溶解氧含量为
_________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修5:有机化学基础]
甲苯在医药、农药,特别是香料合成中应用广泛,可合成以下物质:
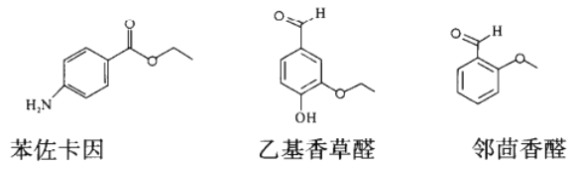
(1)苯佐卡因中含有的碱性官能团为____________(填名称)。
(2)乙基香草醛和邻茴香醛具有相同的亲水基团,该基团可用________(填物理方法)检测。
(3)写出符合下列条件的乙基香草醛的同分异构体的结构简式______(任写两种)。
a.苯环上连接两个互为对位的基团 b.有一个-CH3
c.与FeCl3溶液发生显色反应 d.能发生水解反应
(4)已知:
有机物M为含有两个互为邻位基团的芳香族化合物,且与本佐卡因互为同分异构,其合成路线如下:
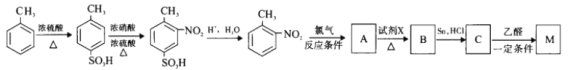
①生成A的“反应条件”为________;
②以上合成路线涉及的7个反应中,属于取代反应的有_________个;
③M的结构简式为___________;
④A→B反应的化学方程式为____________。
(5)参照上述合成路线,以甲苯和甲醇为原料(无机试剂任选),设计制备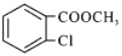 的合成路线___________。
的合成路线___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lgc(SO42-).下列说法正确的是

A. 该温度下,Ksp(BaSO4)=1.0×10-24
B. a点的Ksp(BaSO4)小于b点的Ksp(BaSO4)
C. d点表示的是该温度下BaSO4的不饱和溶液
D. 加入BaCl2可以使溶液由c点变到a点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相关物质的溶度积常数见下表(25℃):
物质 | Mg(OH)2 | CH3COOAg | AgCl | Ag2CrO4 |
Ksp(单位略) | 1.1×10—11 | 2.3×10﹣3 | 1.8×10﹣10 | 1.9×10﹣12 |
下列有关说法中不正确的是
A. 浓度均为0.2 molL﹣1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀
B. 将0.001 molL﹣1的AgNO3溶液滴入0.001 molL﹣1的KCl和0.001 molL﹣1 的K2CrO4混合溶液中.先产生Ag2CrO4沉淀
C. 0.11 molL﹣1的MgCl2溶液中加入氨水产生Mg(OH)2沉淀时溶液的pH为9
D. 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素在元素周期表中的位置为____________________
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 __________________
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4,反应生成N2和水蒸气。
已知①N2(g)=N2O4(l) △H1=-19.5kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) △H2=-534.2kJ·mol-1
肼和N2O4反应的热化学方程式为___________________________
(4)“长征“火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,既能在短时间内产生巨大能量,产物又不污染空气( 产物都是空气成分)。将此原理设计为原电池,如下图所示,据此回答问题:

①B为___________极,从d口排出的气体是____________ 。
②A极发生的电极反应式:____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com