
【题目】对于(NH4)2SO4溶液,下列说法正确的是
A. 溶液中存在电离平衡:(NH4)2SO4![]() 2NH4++SO42-
2NH4++SO42-
B. 向溶液中滴加少量浓硫酸,c(NH4+)与c(SO42-)均增大
C. 加水稀释,溶液中所有离子的浓度均减小
D. 溶液中:c(SO42-)=2c(NH4+)+2c(NH3·H2O)
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】(18分)下图所示是分离混合物时常用的仪器,回答下列问题:
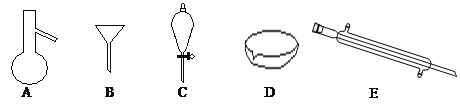
(1)写出仪器C、E的名称 、
(2)分离以下混合物应该主要选用上述什么仪器?(填字母符号)
①NaCl固体和泥沙: ②花生油和水:
(3)若向C装置中加入碘水和足量CCl4,充分振荡后静置,观察到现象是:C内液体分两层,上层液体 色,下层液体 色。
(4)碘单质和溴单质有相类似的性质,都可以用有机溶剂萃取水溶液中的单质,若利用C仪器提取溴水中的溴单质,下列有机溶剂中不能选用的是:
A.汽油 B.CCl4C.酒精 D.醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种优良的消毒剂,常将其制成NaClO2固体,以便运输和贮存,过氧化氢法备NaClO2固体的实验装置如图所示。
已知:①2NaC1O3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②ClO2熔点-59℃、沸点11℃,浓度过高时易发生分解;③H2O2沸点150℃
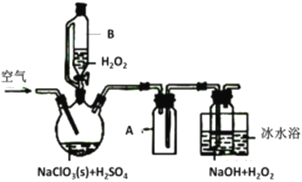
请回答:
(1)仪器B的作用是__________________,仪器A的作用是_________________,冰水浴冷却的目的是____________________(写两种)。
(2)该装置不完善的方面是________________________。
(3)空气流速过快或过慢,均降低NaClO产率,试解释其原因________________________。
(4)Cl-存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步完成,请将其补充完整:①_____________________________(用离子方程式表示),②H2O2+Cl2=2Cl-+O2+2H+
(5)NaClO2纯度测定:①准确称取所得NaClO2样品10.0g于烧杯中,加入适量蒸馏水过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的产物为Cl-),将所得混合液配成250mL待测溶液;②取25.00mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为__________________________,重复滴定3次,测得Na2S2O3标准液平均用量为20.00mL,则该样品中NaClO2的质量分数为____________________。(M(NaClO2)=90.5g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究钠及其化合物有重要意义。
(1)实验室配制0.1molL-1的碳酸钠溶液480mL,根据配制溶液的过程,回答问题:
①实验中除需要托盘天平(带砝码)、药匙、烧杯和玻璃棒外,还需要的其他玻璃仪器是_________。
②实验中需用托盘天平(带砝码)称量碳酸钠固体_______________g。
③某同学配制 Na2CO3溶液的过程如图所示。你认为该同学的错误有___________。

A.①⑥ B.②④⑦ C.①⑤⑥ D.⑤⑥⑦
④下列实验操作会使配得的溶液浓度偏小的是___________。
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容
B.容量瓶使用前没有经过干燥,瓶中有少量的水
C.在容量瓶中定容时俯视刻度线
D.定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度
(2)过氧化钠保存不当容易变质生成Na2CO3。某过氧化钠样品已经部分变质,请你设计实验,限用一种溶液和水,证明过氧化钠已经部分变质:_________________(说明操作、现象和结论)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取50.0mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51g白色沉淀,用 过量稀硝酸处理后沉淀量减少到4.66g,并有气体放出。试计算:
(1)原混合溶液中Na2CO3和Na2SO4的物质的量浓度_______________;
(2)产生的气体在标准状况下的体积_____________。(要有过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硝酸锶Sr(NO3)2可用于制造信号灯,光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:

已知:①“滤渣1”的成份为Ba(NO3)2、Sr(NO3)2 ②铬酸(H2CrO4)为弱酸
(1)“酸浸”不能采用高温的原因是__________________,“滤液1”的主要溶质是_____________________。
(2)相对于水洗,用浓HNO3洗涤的优点是_____________________。
(3)“滤液2”中过量的H2CrO4被N2H4还原为Cr3+,同时放出无污染的气体,写出发生反应的离子方程式:_____________________________________________________。
(4)已知Cr(OH)3类似氢氧化铝,还原后溶液的pH不能大于8的原因是(结合离子方程式说明理由)_______________________________________________________。
(5)为了测定“滤渣2”中BaCrO4的含量,进行以下实验:
+mg“滤渣2” 溶液
溶液![]() 滴定终点时消耗VmLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)
滴定终点时消耗VmLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)
①“滤渣2”中BaCrO4(摩尔质量为Mg/mol)的质量分数为__________(用代数式表示)。
②若加入的HI溶液过量太多,测定结果会_______(“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3·xH2O、Fe2O3、SiO2等)提取纯Al2O3作冶炼铝的原料,提取时操作过程如图,指出图中操作错误的是( )

A. ④⑤ B. ③④
C. ②⑤ D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相关物质的溶度积常数见下表(25℃):
物质 | Mg(OH)2 | CH3COOAg | AgCl | Ag2CrO4 |
Ksp(单位略) | 1.1×10—11 | 2.3×10﹣3 | 1.8×10﹣10 | 1.9×10﹣12 |
下列有关说法中不正确的是
A. 浓度均为0.2 molL﹣1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀
B. 将0.001 molL﹣1的AgNO3溶液滴入0.001 molL﹣1的KCl和0.001 molL﹣1 的K2CrO4混合溶液中.先产生Ag2CrO4沉淀
C. 0.11 molL﹣1的MgCl2溶液中加入氨水产生Mg(OH)2沉淀时溶液的pH为9
D. 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com