
【题目】研究钠及其化合物有重要意义。
(1)实验室配制0.1molL-1的碳酸钠溶液480mL,根据配制溶液的过程,回答问题:
①实验中除需要托盘天平(带砝码)、药匙、烧杯和玻璃棒外,还需要的其他玻璃仪器是_________。
②实验中需用托盘天平(带砝码)称量碳酸钠固体_______________g。
③某同学配制 Na2CO3溶液的过程如图所示。你认为该同学的错误有___________。

A.①⑥ B.②④⑦ C.①⑤⑥ D.⑤⑥⑦
④下列实验操作会使配得的溶液浓度偏小的是___________。
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容
B.容量瓶使用前没有经过干燥,瓶中有少量的水
C.在容量瓶中定容时俯视刻度线
D.定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度
(2)过氧化钠保存不当容易变质生成Na2CO3。某过氧化钠样品已经部分变质,请你设计实验,限用一种溶液和水,证明过氧化钠已经部分变质:_________________(说明操作、现象和结论)。
【答案】 500mL容量瓶、胶头滴管 5.3 A AD 取少量样品于一洁净试管中,加水溶解,向其中加入BaCl2(或CaCl2)溶液,充分振荡,有白色沉淀生成,证明Na2O2已经变质
【解析】(1)①要配制0.1molL-1的碳酸钠溶液480mL,实验室没有480mL的容量瓶,需要选用500mL的容量瓶,配制步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,需要使用的仪器有:托盘天平、玻璃棒、烧杯、药匙、500mL容量瓶、胶头滴管等,还缺少的玻璃仪器为:500mL容量瓶、胶头滴管。
故答案为:500mL容量瓶;胶头滴管;
②依据m=CVM,需要Na2CO3的质量=0.1molL1×0.5L×106g/mol=5.3g;
故答案为:5.3;
③、操作①中称量Na2CO3质量,药品与砝码位置颠倒,正确方法应该为“左物右码”,否则导致称量的碳酸钠质量偏小,故①错误;操作②、③为溶解Na2CO3,使用玻璃棒搅拌,加速溶解过程,操作正确,故②③正确;步骤④为转移冷却后的碳酸钠溶液,需要使用玻璃棒引流,玻璃棒下端放到容量瓶刻度线一下,过程正确,故④正确;步骤⑤为转移洗涤烧杯、和玻璃棒的溶液,该操作正确,故⑤正确;操作⑥为使用胶头滴管定容,定容时眼睛应该与容量瓶刻度线平视,不能仰视刻度线,故⑥错误;操作⑦为摇匀操作,摇匀时应该上下颠倒充分摇匀,故⑦正确;所以以上错误操作有①⑥,故选A。
④A、转移溶液后,未洗涤烧杯和玻璃棒就直接定容,会导致溶质n偏小,溶液浓度偏小,故A正确;B、溶解后立即转移,由于Na2CO3溶于水放热,热胀冷缩,导致溶液V减小,浓度偏大,故B错误;C、进行定容时,俯视刻度线,会导致溶液体积偏小,浓度偏大,故C错误;D、定容且把容量瓶倒置摇匀后,发现液面下降,此时有少量溶液残留在玻璃塞和瓶口之间,浓度不变,属于正常现象,但又补充了水,会导致浓度偏小,故D正确。故答案为:AD。
Na2O2保存不当容易变质,生成Na2CO3,所以检查Na2O2是否变质,只需检验CO32-,选用BaCl2溶液,方法是取少量样品,溶解,加入BaCl2(或CaCl2)溶液,充分振荡,有白色沉淀,证明Na2O2已经变质。
故答案为:取少量样品于一洁净试管中,加水溶解,向其中加入BaCl2(或CaCl2)溶液,充分振荡,有白色沉淀生成,证明Na2O2已经变质。


科目:高中化学 来源: 题型:
【题目】某醛的分子式为C5H10O,其属于醛类的同分异构体种数为______种;写出属于酮的三种同分异构体:________、________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 硫酸铁中加入少量氨水:Fe3++3OH-=Fe(OH)3↓
B. 电解饱和食盐水:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C. 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O
D. 将铝投入CuSO4溶液中:Al+Cu2+=Cu+Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计如下图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应)。回答下列问题:
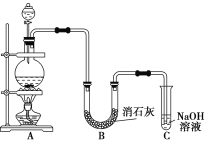
(1)在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,写出反应的化学方程式并用双线桥法表示出反应中电子转移的方向和数目_____________________;若在标准状况下收集到22.4 L氯气,则被氧化的HCl的物质的量是______。
(2)漂白粉将在U形管中产生,其化学方程式是______________。
(3)C装置的作用是_______________________________________。
(4)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是______________________________________________________________。
②试判断另一个副反应__________________________________(用化学方程式表示)。为避免此副反应的发生,可将装置做何改进________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断中一定正确的是( )
A. NaCl及Na2O2固体中阴、阳离子数之比均为1:1
B. 等质量的O2与O3中,氧原子的个数比为3:2
C. 分别用H2O2、KMnO4分解制O2,当制得等质量O2时,转移电子数之比为1:2
D. 10 mL 0.3 mol·L-1 NaCl溶液与30 mL 0.1 mol·L-1 AlCl3溶液中Cl -物质的量浓度比为1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于(NH4)2SO4溶液,下列说法正确的是
A. 溶液中存在电离平衡:(NH4)2SO4![]() 2NH4++SO42-
2NH4++SO42-
B. 向溶液中滴加少量浓硫酸,c(NH4+)与c(SO42-)均增大
C. 加水稀释,溶液中所有离子的浓度均减小
D. 溶液中:c(SO42-)=2c(NH4+)+2c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如右图所示。据图判断正确的是
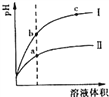
A. Ⅱ为盐酸稀释时的pH值变化曲线
B. b点溶液的导电性比c点溶液的导电性强
C. a点KW的数值比c点KW的数值大
D. b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(1)25 ℃时,等浓度的三种溶液(a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液)的pH由大到小的顺序为________________________________。(填写序号)
(2)25 ℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_____________________。
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是 _______。
A.c(H+)>c(OH-) B. c(H+)<c(OH-)
C.c(H+)+c(HCN) = C(OH-) D.c(HCN)+c(CN-)=0.01mol/L
(4)常温下,将某一元酸HA 和NaOH 溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH 如下表:
实验编号 | HA物质的量浓度(molL-1) | NaOH物质的量浓度(molL-1) | 混合溶液的pH |
a | 0.1 | 0.1 | pH=9 |
b | c | 0.2 | pH=7 |
请回答:
①从a组情况分析, HA是强酸还是弱酸_____________。
②b组情况表明,c_______0.2(选填“大于”“小于”或“等于”)。混合溶液中离子浓度c(A-)________ c(Na+)(选填“大于”“小于”或“等于”)。
③a组实验所得混合溶液中由水电离出的c(OH-)=______molL-1.写出该混合溶液中下列算式的精确结果(不需做近似计算).c(Na+)-c(A-)=______molL-1 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺(CH3NH2) 的性质与氨相似。25℃时,向10mL1.0000mol·L-1甲胺溶液中滴入0.5000mol·L-1的稀硫酸,溶液的pOH 与所加稀硫酸的体积(V)关系如图所示。
已知:pOH=-lgc(OH-),Kb(CH3NH2·H2O)=4.0×10-4。下列说法正确的是( )
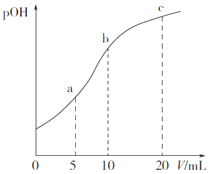
A. pOH=7 时,2c(CH3NH3+)=c(SO42-)
B. 水的电离程度:c>b>a
C. a点溶液中存在:c(CH3NH2·H2O)>c(CH3NH3+)>c(H+)>c(OH-)
D. 25℃时1.000 mol·L-1甲胺溶液中CH3NH2·H2O的电离度约为2.0%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com