
分析 (1)在水溶液中或熔融状态下能导电的化合物为电解质;由两种或以上物质构成的为混合物;
(2)本题要根据氢氧化铁胶体胶体的制备、性质(丁达尔效应、聚沉)和胶体微粒直径的大小解答;
(3)FeCl3、CuCl2和FeSO4的混合溶液中加入铁粉,铁粉先和Fe3+反应,然后再和Cu2+反应,当铁粉无剩余、且有铜生成时,说明Fe3+反应完全,Cu2+已经开始反应,而铁粉无剩余,故Cu2+不一定完全反应,据此分析.
解答 解:(1)①Cu是单质,是纯净物,既不是电解质也不是非电解质; ②1mol•L-1的FeCl3溶液是混合物,既不是电解质也不是非电解质; ③CuCl2溶液是混合物,既不是电解质也不是非电解质;④CO2是纯净物,是非电解质;⑤H2SO4是纯净物,是电解质;⑥酒精是纯净物,是非电解质;⑦CaCO3是纯净物,是电解质;⑧FeSO4
是纯净物,是电解质,故是电解质的是⑤⑦⑧;是混合物的是②③,
故答案为:⑤⑦⑧;②③;
(2))制备氢氧化铁胶体用的水眼泪水解的知识,加热条件下FeCl3的水解生成胶体,因此方程式中要写明条件(加热),特别注意的是:生成的是胶体而不是沉淀,化学方程式为FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;氢氧化铁胶体是胶体分散系中的一种,胶体粒子直径大小在1nm~100nm;胶体区别于溶液的关键在于:溶液粒子直径小于1nm,胶体粒子直径大小在1nm~100nm,即溶液不产生丁达尔效应,而氢氧化铁胶体能产生丁达尔效应,
故答案为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;1~100;用一束光线照射,能产生一条光亮的通路;
(3)当有铜生成,铁粉无剩余,溶液中一定没有Fe3+,Cu2+恰好全部参加反应或部分反应生成Fe2+和Cu,所以溶液中一定没有Fe3+,可能含有Cu2+,一定含有Fe2+;
如果只有Fe2+,则其物质的量为:0.35mol,如果还有Cu2+,且最多为0.1mol时,只发生2FeCl3+Fe=3FeCl2,则Fe2+物质的量为0.25mol,由于两个反应都发生,所以Cu2+小于0.1mol,因此Fe2+物质的量大于0.25mol,故Fe2+物质的量为:0.25mol<n(Fe2+)≤0.35mol,
故答案为:Fe2+;Cu2+;0.25mol<n(Fe2+)≤0.35mol.
点评 本题考查了电解质非电解质的判断、混合物和纯净物的判断以及Fe与Fe3+、Cu2+的反应,熟悉三价铁离子、铜离子氧化性强弱是解题关键,题目难度不大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铜与盐酸的反应 Cu(OH)2+2H+=Cu2++2 H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | 碳酸钙溶于盐酸中 CaCO3+H+=Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
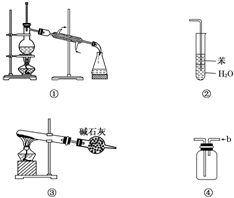
| A. | 装置①常用于分离互不相溶的液体混合物 | |
| B. | 装置②可用于吸收氨气,能够防止倒吸 | |
| C. | 以NH4HCO3为原料,装置③可用于制备少量CO2 | |
| D. | 装置④a口进气可收集Cl2、NO2等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+、Cl-、SO42- | B. | Cu2+、Cl-、NO3-、OH- | ||
| C. | Ca2+、Na+、CO32-、NO3- | D. | K+、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①③④ | C. | ①③⑤⑥ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元 素 | M | F | |
| 电离能 (kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜是负极,铜片上有气泡产生 | B. | 电流从锌片经导线流向铜片 | ||
| C. | H+在铜片表面被还原 | D. | 铜片质量逐渐减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com