
分析 Ⅰ.(1)水电离产生的H+、OH-的浓度乘积即:c(H+)水•c(OH-)水=10-22,则c(H+)=10-11mol/L,根据Kw=10-12计算c(OH),然后计算氢氧化钠的质量;
(2)若保持温度不变,已知Kw=10-12,中性溶液中pH=6,某溶液中c(H+)为1×10-7mol/L<1×10-6mol/L,溶液显碱性;
II.(3)n(NaOH)=1mol/L×0.6L=0.6mol,n(CO2)=$\frac{8.96L}{22.4L/mol}$=0.4mol,n(NaOH):n(CO2)=0.6mol:0.4mol=3:2,
设生成的n(Na2CO3)=xmol、n(NaHCO3)=ymol,
根据Na、C原子守恒得$\left\{\begin{array}{l}{2x+y=0.6}\\{x+y=0.4}\end{array}\right.$,解得$\left\{\begin{array}{l}{x=0.2}\\{y=0.2}\end{array}\right.$,
所以溶液中溶质为等物质的量浓度的Na2CO3、NaHCO3,碳酸根离子水解程度大于碳酸氢根离子,二者水解导致溶液呈碱性;
(4)在FeCl3溶液中加入NaHCO3溶液,二者发生双水解反应生成氢氧化铁沉淀和二氧化碳;溶液的pH=4,则溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10 mol/L,c(Fe3+)=$\frac{{K}_{sp}}{{c}^{3}(O{H}^{-})}$;
(5)FeS(s)?Fe2+(aq)+S2-(aq),加入稀盐酸后,S2-+2H+=H2S↑,促进FeS溶解.
解答 解:I.(1)水电离产生的H+、OH-的浓度乘积即:c(H+)水•c(OH-)水=10-22,则c(H+)=10-11mol/L,已知Kw=10-12,c(OH)=$\frac{1{0}^{-12}}{1{0}^{-11}}$=0.1mol/L,则氢氧化钠的物质的量为0.1mol/L×1L=0.1mol,则质量为0.1mol×40g/mol=4g,
故答案为:4;
(2)若保持温度不变,已知Kw=10-12,中性溶液中pH=6,某溶液中c(H+)为1×10-7mol/L<1×10-6mol/L,溶液显碱性,故答案为:碱;
II.(3)n(NaOH)=1mol/L×0.6L=0.6mol,n(CO2)=$\frac{8.96L}{22.4L/mol}$=0.4mol,n(NaOH):n(CO2)=0.6mol:0.4mol=3:2,
设生成的n(Na2CO3)=xmol、n(NaHCO3)=ymol,
根据Na、C原子守恒得$\left\{\begin{array}{l}{2x+y=0.6}\\{x+y=0.4}\end{array}\right.$,解得$\left\{\begin{array}{l}{x=0.2}\\{y=0.2}\end{array}\right.$,
所以溶液中溶质为等物质的量浓度的Na2CO3、NaHCO3,碳酸根离子水解程度大于碳酸氢根离子,但其水解程度都较小,二者水解导致溶液呈碱性,钠离子不水解,所以溶液中离子浓度大小顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(4)在FeCl3溶液中加入NaHCO3溶液,二者发生双水解反应生成氢氧化铁沉淀和二氧化碳,离子方程式为Fe3++3HCO3-=Fe(OH)3↓+3CO2↑;溶液的pH=4,则溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10 mol/L,c(Fe3+)=$\frac{{K}_{sp}}{{c}^{3}(O{H}^{-})}$=$\frac{4.0×1{0}^{-38}}{(1{0}^{-10})^{3}}$mol/L=4.0×10-8mol/L;
故答案为:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑;4.0×10-8;
(5)FeS(s)?Fe2+(aq)+S2-(aq),加入稀盐酸后,S2-+2H+=H2S↑,破坏了FeS的溶解平衡,使上述平衡向FeS溶解的方向移动,则FeS能溶于稀盐酸,
故答案为:FeS(s)?Fe2+(aq)+S2-(aq),加入稀盐酸后,S2-+2H+=H2S↑,破坏了FeS的溶解平衡,使上述平衡向FeS溶解的方向移动,故FeS溶解.
点评 本题考查较综合,涉及难溶物的溶解平衡、离子浓度大小比较、盐类水解等知识点,为高频考点,侧重考查学生分析、判断及计算能力,注意(3)中溶质及其物质的量之间的关系,为易错点.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:解答题
 硫在空气中燃烧可以生成SO2,SO2在催化剂作用下可以被氧化为SO3,其热化学方程式可表示为:S(g)+O2(g)═SO2(g)△H=-297kJ/mol,SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-98.3kJ/mol.如图是上述两个反应过程与能量变化的关系图,其中Ⅰ表示0.4mol SO2(g)、1.6mol SO3(g)、0.2mol O2(g)具有的能量,Ⅲ表示64gS(g)与96g O2(g)所具有的能量.
硫在空气中燃烧可以生成SO2,SO2在催化剂作用下可以被氧化为SO3,其热化学方程式可表示为:S(g)+O2(g)═SO2(g)△H=-297kJ/mol,SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-98.3kJ/mol.如图是上述两个反应过程与能量变化的关系图,其中Ⅰ表示0.4mol SO2(g)、1.6mol SO3(g)、0.2mol O2(g)具有的能量,Ⅲ表示64gS(g)与96g O2(g)所具有的能量.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 无机化合物可根据其组成和性质进行分类,
无机化合物可根据其组成和性质进行分类,| 物质类别 | 酸 | 碱 | 盐 | 酸性 氧化物 | 碱性 氧化物 |
| 化学式 | ①H2SO4、H2SO3、HNO3、H2CO3 ②H2S | ③NaOH、KOH、NH3.H2O ④Ba(OH)2 | ⑤Na2CO3 ⑥Na2SO3、NaNO3、K2SO4、K2CO3、KNO3 | ⑦SO2 ⑧-- | ⑨-- ⑩-- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

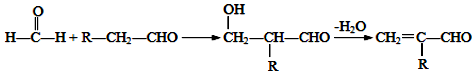
 .
.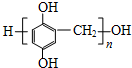 (写出一种即可).
(写出一种即可).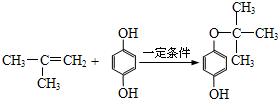 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它可能能使酸性高锰酸钾溶液褪色 | |
| B. | 一氯代物可能只有一种 | |
| C. | 分子结构中甲基的数目可能是0、1、2 | |
| D. | 等质量CH4和C4H8分别在氧气中完全燃烧,CH4的耗氧量小于C4H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3S+6NaOH═Na2SO3+2Na2S+3H2O | |
| B. | 3NO2+H2O═2HNO3+NO | |
| C. | 2FeCl2+Cl2=3FeCl3 | |
| D. | 4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3•H2O)>c(CO32-) | |
| B. | NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3•H2O)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | 由图可知,往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小 | |
| D. | 通过分析可知常温下Ka1(H2CO3)>Kb(NH3•H2O)>Ka2(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO的结构式:H-Cl-O | B. | 氨气分子的比例模型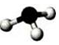 | ||
| C. | 原子核内有10个中子的氧原子:18O | D. | H2与H+互为同位素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com