
【题目】欲用下图装置对所制备的气体进行除杂检验,其设计方案合理的是
制备气体 | X(除杂试剂) | Y(检验试剂) |
| |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 | |
B | 电石与NaCl水溶液 | H2O | Br2的水溶液 | |
C | C2H5OH与浓硫酸加热至170℃ | 饱和NaHSO3溶液 | K2Cr2O7酸性溶液 | |
D | 生石灰与浓氨水 | 浓硫酸 | 红色石蕊试纸 |
A. A B. B C. C D. D
【答案】A
【解析】A. CH3CH2Br与NaOH乙醇溶液共热生成乙烯,而挥发的乙醇也能使酸性高锰酸钾溶液褪色,干扰检验试验的进行,需要用水吸收乙醇,故A正确;B. 电石与水反应生成的乙炔中有硫化氢杂质,均具有还原性,应该用硫酸铜溶液除去硫化氢,故B错误;C. 乙醇在浓硫酸加热170℃发生消去反应生成乙烯气体,同时乙醇和浓硫酸在170℃以上能发生氧化反应,生成黑色碳、二氧化硫气体和水,含有的杂质二氧化硫不能被饱和NaHSO3溶液吸收,而二氧化硫也能使K2Cr2O7酸性溶液褪色,故C错误;D. 生石灰与水反应生成氢氧化钙,同时放出大量热,使浓氨水分解,放出氨气,氨气能够与浓硫酸反应被吸收,不能检验到生成的氨气,故D错误;故选A。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L 硫酸溶液进行中和热的测定,实验装置如图所示。

(1)已知中和热的理论值△H= -57.3kJ·mol-1,写出NaOH溶液和稀硫酸反应的中和热的热化学方程式:_______________。
(2)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
实验组 | 起始温度t1/℃ | 终止温度 t2/℃ | |
H2SO4 | NaOH | ||
1 | 26.2 | 26.0 | 30.1 |
2 | 27.0 | 27.4 | 33.1 |
3 | 26.4 | 26.2 | 30.5 |
①中和热△H=____________(取小数点后一位)。[已知:比热容c=4.18J·(g·℃)-1]
②上述实验数值结果与-57.3 kJ·mol-1有偏差,产生偏差的原因可能是______(填字母)。
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.量取NaOH溶液的体积时仰视读数
d.用温度计测定NaOH溶液起始温度后直接测量硫酸的温度
(3)若取100mL0.50mol/L NaOH溶液和50mL0.50mol/L 硫酸进行中和热的测定,其它实验条件相同,则所测得中和热的数值______(填“偏大”、“偏小”或“不变”)。
(4)已知一元弱酸HA(aq)与NaOH(aq)反应生成1mol H2O(l)时的△H= -23.1 kJ·mol-1,依据中和热的理论值,则HA(aq)![]() H+(aq)+A-(aq)的△H=____________。
H+(aq)+A-(aq)的△H=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二钒广泛用于冶金、化工等行业,主要用于冶炼钒铁.用作合金添加剂,占五氧化二钒总消耗量的80%以上,其次是用作有机化工的催化剂,为了增加V2O5的利用率,我们从废钒催化剂(主要成分V2O5,VOSO4,K2SO4,SiO2和Fe2O3等)中回收V2O5的一种生产工艺流程示意图如下:

部分含钒物质在水中的溶解性如下,回答下列问题:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解牲 | 可溶 | 难溶 | 难溶 | 易溶 |
(l)①中废渣的主要成分是____;①中V2O5发生反应的离子方程式为_____________。
(2)②,③中的变化过程可简化为(下式中的R表示VO2+或Fe3+,HA表示有机萃取剂的主要成分):R2(SO4)n(水层)+2nHA(有机层)![]() 2RA(有机层)+nH2SO4(水层)。②中萃取时必须加入适量碱,其原因是________________;实验室进行萃取操作主要使用的玻璃仪器为________________。
2RA(有机层)+nH2SO4(水层)。②中萃取时必须加入适量碱,其原因是________________;实验室进行萃取操作主要使用的玻璃仪器为________________。
(3)实验室用的原料中V2O5占6%(原料中的所有钒已换算成V2O5)。取l00g该废钒催化剂按工业生产的步骤进行实验,当加入100 mL0.1mol/L的KC1O3溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该实验中钒的回收率是____(己知V2O5的相对分子质量为182)。
(4) 25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间的关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.6 | 96.4 | 93.1 | 89.3 |
试判断在实际生产时,⑤中加入氨水调节溶液的最佳pH为_________;若钒沉淀率为93.1%时不产生Fe( OH)3沉淀,则此时溶液中c(Fe3+)=_________。(已知:25℃时k[Fe(OH)3]=2.6×l0-39.)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液X中只可能溶有K+、Mg2+、A13+、AlO2-、SiO32-、CO32-、SO32-、SO42-中的若干种离子。某同学对该溶液进行了如下实验:

下列判断正确的是
A. 气体甲一定是纯净物 B. 沉淀甲是硅酸和硅酸镁的混合物
C. K+、AlO2-、SiO32-一定存在于溶液X中 D. CO32-和SO42-一定不存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中,下列离子能大量共存的是
A. Fe2+、Na+、SO42-、Cl-
B. Na+、Ba2+、CO32-、NO3-
C. Cu2+、K+、Cl-、SO42-
D. K+、Na+、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
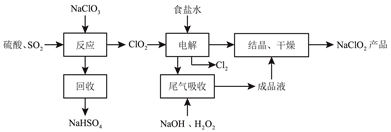
已知:亚氯酸钠在温度高于80℃时分解。下列说法不正确的是( )
A. “反应”步骤中生成ClO2的化学方程式是:2NaClO3+SO2+H2SO4===2NaHSO4+2ClO2
B. 电解食盐水的阴极产物是NaOH和H2
C. ClO2尾气吸收时氧化剂和还原剂的物质的量之比为1:1
D. 从NaClO2溶液中得到NaClO2产品,应采用减压蒸发的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境问题成为人类共同关注的问题,欧洲很多国家提出了燃油车2036年停产时间表。也有专家提出燃油车远未到穷途末路,只要解决燃油汽车排放的尾气中的SO2、CO和NO污染问题就还有很长的生命,请回答以下问题:
(1)在汽车尾气管中加装催化剂成为汽车尾气治理的常用方法,已知:
①N2(g)+ O2(g)=2NO(g) △H=180.5 kJ/mol
②2CO(g)+ O2(g)=2CO2(g) △H=-566kJ/mol
写出NO(g)与CO(g)在催化剂作用下转化成N2(g)和CO2(g)的热化学方程式________________________。
(2)汽车尾气中的少量NO2也可以和CO反应生成N2(g)和CO2(g),热化学方程式为:
2NO2(g)+4CO(g)= N2(g)+4CO2(g) ,ΔH=QkJ·mol-1,试判断Q_______0(填“>”或“<”或“=”)。理由是_________________________________________
(3)除了汽车尾气产生的污染外,工业尾气及北方冬季燃煤产生SO2的污染治理也非常重要,可模仿工业上用2SO2(g )+O2(g) ![]() 2SO3(g)以制取硫酸,现在一容积固定为10L的密闭容器中进行该反应,现测得如下数据:
2SO3(g)以制取硫酸,现在一容积固定为10L的密闭容器中进行该反应,现测得如下数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
SO2 | O2 | SO2 | |||
1 | 550 | 4 | 2 | 0.4 | 9 |
2 | 650 | 2 | 1 | 0.4 | 3 |
3 | 650 | a | b | c | t |