
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5。
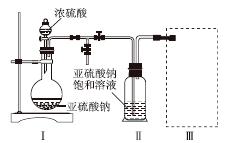
(1)装置Ⅰ中产生气体的化学方程式为______________________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是______。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO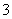 的电离程度大于水解程度,可采用的实验方法是________(填序号)。
的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液
c.加入盐酸 d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检测Na2S2O5晶体在空气中已被氧化的实验方案是
________________________________________________________________________
________________________________________________________________________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
(1)Na2SO3+H2SO4===Na2SO4+SO2↑+H2O(或Na2SO3+2H2SO4===2NaHSO4+SO2↑+H2O)
(2)过滤 (3)d (4)a、e
(5)取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成 (6)①0.16 ②偏低
[解析] (1)据装置Ⅱ中所发生的反应可知:装置Ⅰ是制取SO2的发生装置,其化学方程式为Na2SO3 + H2SO4 === Na2SO4 + SO2↑+ H2O或者Na2SO3 + 2H2SO4===2NaHSO4 + SO2↑+ H2O。(2)析出的晶体要从溶液中获得可通过过滤的方法。(3)a中吸收尾气SO2的装置末端没有与大气相通,错误;b中该装置中SO2虽能与水反应且易溶于水,但还会有部分SO2进入空气,同时也会发生倒吸,错误;c中的浓硫酸不与SO2反应,错误;d中处理尾气SO2的同时也可起到防倒吸的作用,正确。(4)只要能证明NaHSO3溶液呈酸性的方法就可以,则选择a和e。(5)Na2S2O5中S元素的化合价为+4,若被氧气氧化则生成SO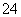 ,检验Na2S2O5晶体在空气中已被氧化的方案相当于检验硫酸根离子,则其实验方案是:取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量的盐酸振荡,再滴入氯化钡溶液,有白色沉淀生成。
,检验Na2S2O5晶体在空气中已被氧化的方案相当于检验硫酸根离子,则其实验方案是:取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量的盐酸振荡,再滴入氯化钡溶液,有白色沉淀生成。
(6) ①SO2 + 2H2O + I2===H2SO4 + 2HI
64 g 1 mol
x 0.01×25×10-3mol
求得:x=1.6×10-2g
则样品中抗氧化剂的残留量=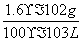 =0.16 g/L。
=0.16 g/L。
②. 若有部分HI被空气氧化生成I2,则所消耗标准I2溶液的体积减少,则测得样品中抗氧化剂的残留量将偏低。


科目:高中化学 来源: 题型:
亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程:
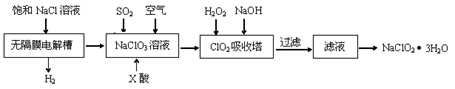
已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用。
②ClO2气体在中性和碱性溶液中不能稳定存在。
(1)在无隔膜电解槽中持续电解一段时间后,生成氢气和NaClO3,请写出阳极的电极反应方程式 。
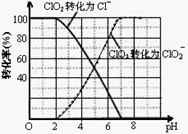 (2)反应生成ClO2气体需要X酸酸化,X酸可以为 。
(2)反应生成ClO2气体需要X酸酸化,X酸可以为 。
A.盐酸 B.稀硫酸 C.硝酸 D.H2C2O4溶液
(3)吸收塔内的温度不能过高的原因为 。
(4)ClO2被S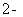 还原为ClO
还原为ClO 、Cl
、Cl 转化率与pH关系如图。
转化率与pH关系如图。
写出pH≤2时ClO2与S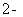 反应的离子方程式: 。
反应的离子方程式: 。
(5)ClO2对污水中Fe2+、Mn2+、S2-和CN 等有明显的去除效果。某工厂污水中含CN
等有明显的去除效果。某工厂污水中含CN amg/L,现用ClO2将CN
amg/L,现用ClO2将CN 氧化,生成了两种无毒无害的气体,其离子反应方程式为_______________________;处理100 m3这种污水,至少需要ClO2 _____________ mol。
氧化,生成了两种无毒无害的气体,其离子反应方程式为_______________________;处理100 m3这种污水,至少需要ClO2 _____________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关有机物分子的叙述不正确的是
A.乙烯分子中有一个sp2-sp2σ键和一个p-pπ键
B.乙炔每个碳原子都有两个未杂化的2p轨道,它们之间可形成两个π键
C.乙烷两个C原子均是sp3杂化,分子中一共有6个σ键
D.苯分子中的碳原子采用sp2杂化,且每个碳原子均存在一个未参与杂化的p轨道。
查看答案和解析>>
科目:高中化学 来源: 题型:
茶叶中铁元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )
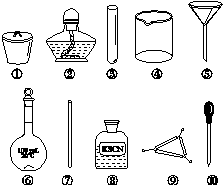
A.将茶叶灼烧灰化,选用①、②和⑨
B.用浓硝酸溶解茶叶并加蒸馏水稀释,选用④、⑥和⑦
C.过滤得到滤液,选用④、⑤和⑦
D.检验滤液中的Fe3+,选用③、⑧和⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述Ⅰ和Ⅱ均正确并有因果关系的是( )
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | KNO3的溶解度大 | 用重结晶法除去KNO3 中混有的NaCl |
| B | BaSO4难溶于酸 | 用盐酸和BaCl2 溶液检测SO |
| C | NH3能使酚酞溶液变红 | NH3可用于设计喷泉实验 |
| D | Ca(OH)2能制成 澄清石灰水 | 可配制2.0 mol·L-1 的Ca(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制备下列气体时,所用方法正确的是( )
A.制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置
B.制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体
C.制乙烯时,用排水法或向上排空气法收集气体
D.制二氧化氮时,用水或NaOH溶液吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
茶叶中铁元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )

A.将茶叶灼烧灰化,选用①、②和⑨
B.用浓硝酸溶解茶叶并加蒸馏水稀释,选用④、⑥和⑦
C.过滤得到滤液,选用④、⑤和⑦
D.检验滤液中的Fe3+,选用③、⑧和⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
B.[实验化学]
磷酸铁(FePO4·2H2O,难溶于水的米白色固体)可用于生产药物、食品添加剂和锂离子电池的正极材料。实验室可通过下列实验制备磷酸铁。
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤。反应加热的目的是__________________________________。
(2)向滤液中加入一定量H2O2氧化Fe2+。为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式如下:
Cr2O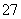 +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
①在向滴定管中注入K2Cr2O7标准溶液前,滴定管需要检漏、____________________和__________________。
②若滴定x mL滤液中的Fe2+,消耗a mol·L-1 K2Cr2O7标准溶液b mL,则滤液中c(Fe2+)=________mol·L-1。
③为使滤液中的Fe2+完全被H2O2氧化,下列实验条件控制正确的是________(填序号)。
A.加入适当过量的H2O2溶液
B.缓慢滴加H2O2溶液并搅拌
C.加热,使反应在较高温度下进行
D.用氨水调节溶液pH=7
(3)将一定量的Na2HPO4溶液(溶液显碱性)加入到含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO4·2H2O。若反应得到的FePO4·2H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.核能、太阳能、生物质能、风能、氢能均属于新能源
C.自发反应的熵一定增大,非自发反应的熵一定减小
D.常温下,反应C(s)+CO2(g) 2CO(g)不能自发进行,则该反应的ΔH>0
2CO(g)不能自发进行,则该反应的ΔH>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com