
亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程:
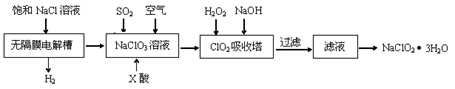
已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用。
②ClO2气体在中性和碱性溶液中不能稳定存在。
(1)在无隔膜电解槽中持续电解一段时间后,生成氢气和NaClO3,请写出阳极的电极反应方程式 。
 (2)反应生成ClO2气体需要X酸酸化,X酸可以为 。
(2)反应生成ClO2气体需要X酸酸化,X酸可以为 。
A.盐酸 B.稀硫酸 C.硝酸 D.H2C2O4溶液
(3)吸收塔内的温度不能过高的原因为 。
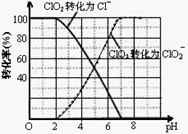
(4)ClO2被S 还原为ClO
还原为ClO 、Cl
、Cl 转化率与pH关系如图。
转化率与pH关系如图。
写出pH≤2时ClO2与S 反应的离子方程式: 。
反应的离子方程式: 。
(5)ClO2对污水中Fe2+、Mn2+、S2-和CN 等有明显的去除效果。某工厂污水中含CN
等有明显的去除效果。某工厂污水中含CN amg/L,现用ClO2将CN
amg/L,现用ClO2将CN 氧化,生成了两种无毒无害的气体,其离子反应方程式为_______________________;处理100 m3这种污水,至少需要ClO2 _____________ mol。
氧化,生成了两种无毒无害的气体,其离子反应方程式为_______________________;处理100 m3这种污水,至少需要ClO2 _____________ mol。
科目:高中化学 来源: 题型:
煤的气化是煤高效、洁净利用的方向之一。下图为加热某地煤样所得煤气组成及体积分数随温度变化的曲线图。由图可知该煤气中( )。

A.只含有碳、氢两种元素
B.所含的有机物是CH4,CnHm,CO
C.CO体积分数小于CH4体积分数
D.氢气体积分数最大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于电解精炼铜的叙述中不正确的是( )
A.粗铜板:阳极
B.电解时,阳极发生氧化反应,而阴极发生的反应为Cu2++2e-====Cu
C.粗铜中所含Na、Fe、Zn等杂质,电解后以单质形式沉积槽底,形成阳极泥
D.电解铜的纯度可达99.95 %—99.98 %
查看答案和解析>>
科目:高中化学 来源: 题型:
按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。

下列说法错误的是( )
A.步骤(1)需要过滤装置 B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚 D.步骤(4)需要蒸馏装置
查看答案和解析>>
科目:高中化学 来源: 题型:
将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500ml 2mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO2的物质的量为( )
A.0.2mol B.0.6mol C.0.8mol D.1.0mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在3BrF3+5H2O===HBrO3+Br2+9HF+O2↑中,若有5 mol水做还原剂时,被水还原的BrF3的物质的量是( )
A.3 mol B.2 mo C.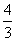 mol D.
mol D.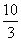 mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于工业生产的说法中,不正确的是( )
A.工业上,用焦炭在电炉中还原二氧化硅得到含杂质的粗硅
B.生产普通水泥的主要原料有石灰石、石英和纯碱
C.工业上将粗铜进行精炼,应将粗铜连接在电源的正极
D.在高炉炼铁的反应中,一氧化碳作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y是主族元素,I为电离能,单位是kJ/mol。根据下表所列数据判断错误的是
元素 | I1 | I2 | I3 | I4 |
X | 500 | 4600 | 6900 | 9500 |
Y | 580 | 1800 | 2700 | 11600 |
A.元素Y的常见化合价是+3价 B.元素X是ⅠA族的元素
C.元素X与氧形成化合物时,化学式可能是X2O2
D.若元素Y处于第3周期,它可与冷水剧烈反应
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5。
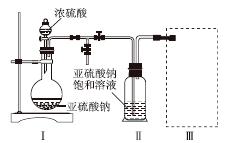
(1)装置Ⅰ中产生气体的化学方程式为______________________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是______。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO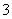 的电离程度大于水解程度,可采用的实验方法是________(填序号)。
的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液
c.加入盐酸 d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检测Na2S2O5晶体在空气中已被氧化的实验方案是
________________________________________________________________________
________________________________________________________________________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com