
| A.40s | B.15s | C.30s | D.20s |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| 编号 | 金属(粉末状) | 物质的量 | 酸的浓度 | 酸的体积 | 反应温度 |
| A | Al | 0.2 mol | 18.4mol/L H2SO4 | 10mL | 30℃ |
| B | Mg | 0.2 mol | 3 mol/L H2SO4 | 20mL | 30℃ |
| C | Fe | 0.1 mol | 3 mol/L H2SO4 | 20mL | 60℃ |
| D | Mg | 0.1 mol | 3 mol/L H2SO4 | 10mL | 60℃ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4ClO2↑+H++Cl-+2H2O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,其原因可能是……( )。
4ClO2↑+H++Cl-+2H2O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,其原因可能是……( )。| A.逸出ClO2使生成物浓度降低 | B.酸使亚氯酸的氧化性增强 |
| C.溶液中的H+起催化作用 | D.溶液中的Cl-起催化作用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2CO(g),能使反应速率加快的措施是( )
2CO(g),能使反应速率加快的措施是( )| A.①②③⑥ | B.①②④⑥ |
| C.①②③④ | D.①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)
2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)| 编号 | 改变的条件 | 化学反应速率 |
| ① | 降低温度 | |
| ② | 增大O2的浓度 | |
| ③ | 使用V2O5作催化剂 | |
| ④ | 压缩体积 | |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


| 编号 | ①号试管 | ②号试管 |
| 褪色时间 | 90s | 5 s |
| 实验现象 | 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 | |
| 编号 | ①号试管 | ②号试管 |
| 褪色时间 | 100 s | 90 s |
| 实验现象 | 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 | |
| 编号 | ①号试管 | ②号试管 | ③号试管 |
| 褪色时间 | 88 s | 100 s | 120 s |
| 实验现象 | 均有气泡产生;①号试管的溶液褪色比②、③号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 | ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
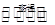 Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②④⑥ | B.①② | C.②③⑤ | D.②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验 编号 | T/K | 大理石 规格 | HNO3浓度(mol·L-1) | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和 探究温度对该反应速率的影响; (Ⅲ)实验①和 探究大理石规格(粗、细)对该反应速率的影响;) |
| ② | | | | |
| ③ | | | | |
| ④ | | | |
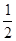 CaCO3+HNO3=
CaCO3+HNO3=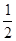 Ca(NO3)2+
Ca(NO3)2+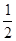 CO2↑+
CO2↑+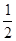 H2O,计算实验①在70~90 s范围内HNO3的平均反应速率为 。(可用分数表示)
H2O,计算实验①在70~90 s范围内HNO3的平均反应速率为 。(可用分数表示)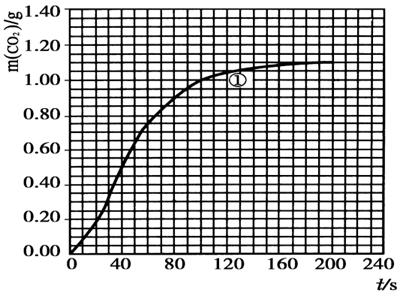
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com