
| 编号 | 金属(粉末状) | 物质的量 | 酸的浓度 | 酸的体积 | 反应温度 |
| A | Al | 0.2 mol | 18.4mol/L H2SO4 | 10mL | 30℃ |
| B | Mg | 0.2 mol | 3 mol/L H2SO4 | 20mL | 30℃ |
| C | Fe | 0.1 mol | 3 mol/L H2SO4 | 20mL | 60℃ |
| D | Mg | 0.1 mol | 3 mol/L H2SO4 | 10mL | 60℃ |
科目:高中化学 来源:不详 题型:实验题
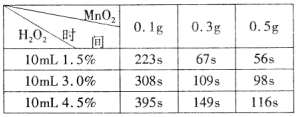
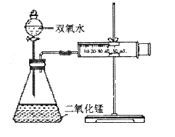
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 温度 | 浓度 | 催化剂 |
| A | 25℃ | 2mL5%H2O2 | 0.1mol/LFeCl32滴 |
| B | 35℃ | 2mL8%H2O2 | MnO2粉末 |
| C | 25℃ | 2mL5%H2O2 | MnO2粉末 |
| D | 25℃ | 2mL8%H2O2 | 0.1mol/LCuCl22滴 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3 ΔH<0的速率—时间图象,则t1时刻使平衡发生移动的原因是
2NH3 ΔH<0的速率—时间图象,则t1时刻使平衡发生移动的原因是
| A.升高温度,同时增大压强 |
| B.降低温度,同时减小压强 |
| C.增大反应物的浓度,同时使用适宜的催化剂 |
| D.增大反应物的浓度,同时减小生成物的浓度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验 序号 | 金属质量 /g | 金属 状态 | c(H2SO4) /mol·L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 2 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 4 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将食物储存在冰箱里 |
| B.在稀H2SO4与NaOH溶液反应时,增大压强 |
| C.往H2O2溶液中加入几滴FeCl3溶液 |
| D.用18mol/L H2SO4溶液代替1 mol/L H2SO4溶液与铁反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.40s | B.15s | C.30s | D.20s |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com