

科目:高中化学 来源:不详 题型:单选题
 mC(g)+ nD(g);△H<0,下列说法正确的是
mC(g)+ nD(g);△H<0,下列说法正确的是| A.浓度改变平衡必移动 | B.增大压强平衡必移动 |
| C.升高温度平衡必移动 | D.导入氦气平衡必移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.①②④ | C.①②③④ | D.全部 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
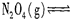


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 编号 | 金属(粉末状) | 物质的量 | 酸的浓度 | 酸的体积 | 反应温度 |
| A | Al | 0.2 mol | 18.4mol/L H2SO4 | 10mL | 30℃ |
| B | Mg | 0.2 mol | 3 mol/L H2SO4 | 20mL | 30℃ |
| C | Fe | 0.1 mol | 3 mol/L H2SO4 | 20mL | 60℃ |
| D | Mg | 0.1 mol | 3 mol/L H2SO4 | 10mL | 60℃ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将木炭粉碎成粉末状可以加快化学反应速率 |
| B.升高温度可以加快化学反应速率 |
| C.增加压强可以加快化学反应速率 |
| D.增加木炭的量可以加快化学反应速率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碳酸钠(固体) | B.硝酸钾溶液 | C.硫酸钾溶液 | D.硫酸铵(固体) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.反应的化学方程式:2M N N |
| B.t2时,正、逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时N的浓度是M浓度的2倍 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


| 编号 | ①号试管 | ②号试管 |
| 褪色时间 | 90s | 5 s |
| 实验现象 | 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 | |
| 编号 | ①号试管 | ②号试管 |
| 褪色时间 | 100 s | 90 s |
| 实验现象 | 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 | |
| 编号 | ①号试管 | ②号试管 | ③号试管 |
| 褪色时间 | 88 s | 100 s | 120 s |
| 实验现象 | 均有气泡产生;①号试管的溶液褪色比②、③号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com