

A.反应的化学方程式:2M N N |
| B.t2时,正、逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时N的浓度是M浓度的2倍 |
 2M,A不正确。t2时,M和N的物质的量还是变化的,所以正、逆反应速率不相等,没有达到平衡状态,B不正确;t3时,M和N的物质的量不再变化,所以正、逆反应速率相等,达到平衡状态,C不正确;根据图像可知,选项D正确,答案选D。
2M,A不正确。t2时,M和N的物质的量还是变化的,所以正、逆反应速率不相等,没有达到平衡状态,B不正确;t3时,M和N的物质的量不再变化,所以正、逆反应速率相等,达到平衡状态,C不正确;根据图像可知,选项D正确,答案选D。

科目:高中化学 来源:不详 题型:单选题
| A.将5 mL 0.02 mol/L的H2SO4溶液与5 mL 0.02 mol/L NaOH溶液充分混合,若混合后溶液的体积为10 mL,则混合液的pH=2 |
| B.某物质的溶液中由水电离的c(H+) = 1×10-a mol/L,若a>7,则pH一定为14-a |
| C.pH相等的①CH3COONa②C6H5ONa③NaHCO3溶液中,c(Na+)大小关系:①>③>② |
| D.CH3COONa溶液中加入少量KNO3固体后的碱性溶液一定有: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将食物储存在冰箱里 |
| B.在稀H2SO4与NaOH溶液反应时,增大压强 |
| C.往H2O2溶液中加入几滴FeCl3溶液 |
| D.用18mol/L H2SO4溶液代替1 mol/L H2SO4溶液与铁反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.②③④⑤ | C.①②③④ | D.②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快。 |

查看答案和解析>>
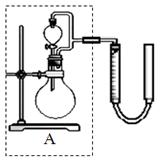
科目:高中化学 来源:不详 题型:实验题
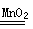 2H2O+O2↑可制备氧气。① 取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
2H2O+O2↑可制备氧气。① 取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | | |
| 2 | 20 | FeCl3溶液 | | |
| 3 | 20 | MnO2 | | |
| 4 | 20 | 无 | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com