
分析 物质A是一种高熔点化合物,不溶于硫酸、硝酸等强酸.A与纯碱熔融反应,生成化合物B,同时放出气体C;把气体C通入B的溶液中,则得到化合物D;D在干燥空气中转变为化合物E;将E加热又得到化合物A,可初步判断A可能是SiO2,B可能是Na2SiO3,C可能是CO2.若把CO2通入Na2SiO3溶液中,会得到胶状沉淀H4SiO4,H4SiO4在干燥空气中易脱水生成H2SiO3,H2SiO3加热生成SiO2.带入验证反应过程设定符合.
解答 解:A是不溶于硫酸、硝酸等强酸的高熔点化合物,它能与纯碱熔融反应,而且放出气体C,生成化合物B,可初步判断A可能是SiO2,B可能是Na2SiO3,C可能是CO2.若把CO2通入Na2SiO3溶液中,会得到胶状沉淀H4SiO4,H4SiO4在干燥空气中易脱水生成H2SiO3,H2SiO3加热生成SiO2.带入验证反应过程设定符合;
推断各物质为:A:SiO2,B:Na2SiO3,C:CO2,D:H4SiO4,E:H2SiO3;
(1)化合物A、E的化学式:A:SiO2; E:H2SiO3,故答案为:SiO2;H2SiO3;
(2)将少量CO2通入Na2SiO3的溶液发生反应的方程式:CO2+Na2SiO3+2H2O=H4SiO4+Na2CO3,故答案为:CO2+Na2SiO3+2H2O=H4SiO4+Na2CO3;
(3)二氧化硅溶于氢氟酸;反应的化学方程式为:SiO2+4HF=SiF4+2H2O,故答案为:氢氟酸;SiO2+4HF=SiF4+2H2O.
点评 本题考查了物质转化关系和物质性质的分析应用,转化关系的反应条件和反应特征是推断的突破口,掌握特征反应是解题关键,题目难度中等.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,断开化学键吸收的能量大于形成化学键所放出的能量 | |
| C. | 该反应中反应物的总能量高于生成物的总能量 | |
| D. | 反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O△H=QKJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂不能改变反应速率 | B. | 降低压强能使反应速率加快 | ||
| C. | 改变压强对反应速率没有影响 | D. | 升高温度能加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 ;
;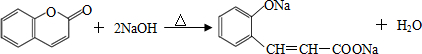 ;
; 或
或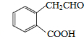 (任写一种);
(任写一种);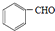 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
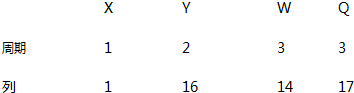
| A. | Y 的氢化物沸点高于 Q 的氢化物沸点 | |
| B. | 最高正价与最低负价之和为 0 的元素只有 W | |
| C. | 原子半径顺序为:r(W)>r(Q)>r(Y)>r(X) | |
| D. | X、Y、Q 三元素形成的分子中,原子最外层电子数之和最大为 32 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
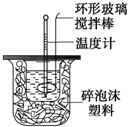 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com