
下列热化学方程式正确的是(△H的绝对值均正确)( )
| A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)△H=-1367.0kJ·mol-1(燃烧热) |
| B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=+57.3kJ·mol-1(中和热) |
| C.S(s)+O2(g)=SO2(g)ΔH=-269.8kJ·mol-1(反应热) |
| D.2NO2=2NO+O2ΔH=+116.2kJ·mol-1(反应热) |
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:单选题
通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应物的总键能与生成物的总键能之差。
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
 Si(s)+4HCl(g),该反应的反应热△H为( )
Si(s)+4HCl(g),该反应的反应热△H为( )查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列热化学方程式正确的是(△H的绝对值均正确)( )
| A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ; ΔH=-1 367.0 kJ·mol-1(燃烧热) |
| B.Ba(OH)2(aq)+2HCl(aq)=BaCl2(aq)+2H2O(l); ΔH=-57.3 kJ·mol-1(中和热) |
| C.S(s)+O2(g)=SO2(g); ΔH=-269.8 kJ·mol-1(反应热) |
| D.2NO2=O2+2NO; ΔH=+116.2 kJ·mol-1(反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知298 K时,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,推测含1 mol HCl的稀溶液与含1 mol NH3的稀溶液反应放出的热量 ( )
| A.大于57.3 kJ | B.等于57.3 kJ |
| C.小于57.3 kJ | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
根据下列热化学方程式:
(1)C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
(2)H2(g)+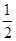 O2(g)=H2O(l) ΔH2=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH2=-285.8 kJ·mol-1
(3)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH3=-870.3 kJ·mol-1
可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为 ( )
| A.ΔH=+244.1 kJ·mol-1 |
| B.ΔH=-488.3 kJ·mol-1 |
| C.ΔH=-996.6 kJ·mol-1 |
| D.ΔH=+996.6 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
反应:2H2(g)+O2(g)===2H2O(l)过程中的能量变化如图所示,下列有关说法中正确的是( )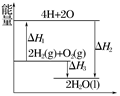
| A.ΔH1<0 | B.ΔH2为该反应的反应热 |
| C.ΔH3不是H2的燃烧热 | D.ΔH2=ΔH1+ΔH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
工业生产水煤气的反应为:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.4 kJ/mol,下列判断正确的是( )
| A.反应物能量总和小于生成物能量总和 |
| B.CO(g)+H2(g)=C(s)+H2O(g) ΔH=+131.4 kJ/mol |
| C.水煤气反应中,生成1 mol H2(g)吸收131.4 kJ热量 |
| D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
① H2(g)+I2(?) 2HI(g)+9.48kJ② H2(g)+I2(?)
2HI(g)+9.48kJ② H2(g)+I2(?) 2HI(g)-26.48kJ
2HI(g)-26.48kJ
下列判断正确的是
| A.①中的I2为固态,②中的I2为气态 |
| B.②的反应物总能量比①的反应物总能量低 |
| C.①的产物比反应②的产物热稳定性更好 |
| D.1mol 固态碘升华时将吸热17kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氢气虽然是一种理想的绿色能源,但目前仍处在研究、实验阶段,还未得到广泛应用,其原因可能是
| A.氢气虽可由水制备获得,但水资源严重匮乏 |
| B.氢气制备耗能巨大,廉价制氢技术尚未成熟 |
| C.氢气贮存、运输等安全技术已经很好地解决了 |
| D.氢气燃烧产物虽无污染,但其放出热量较少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com