
ͨ�����ǰѲ�1 molij��ѧ�������ĵ��������ɸû�ѧ���ļ��ܡ����ܵĴ�С���Ժ�����ѧ����ǿ����Ҳ�����ڹ��㻯ѧ��Ӧ�ķ�Ӧ�ȣ���H������ѧ��Ӧ�ġ�H���ڷ�Ӧ����ܼ�������������ܼ���֮�
| ��ѧ�� | Si��O | Si��Cl | H��H | H��Cl | Si��Si | Si��C |
| ����/kJ��mol��1 | 460 | 360 | 436 | 431 | 176 | 347 |
 Si��s����4HCl��g�����÷�Ӧ�ķ�Ӧ�ȡ�HΪ�� ��
Si��s����4HCl��g�����÷�Ӧ�ķ�Ӧ�ȡ�HΪ�� ��
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ѹǿΪ2��20��104 kPa���¶ȴﵽ374��ʱ��ˮ��Ϊ�����ٽ�״̬������ʱˮ�ɽ�CO2�Ⱥ�̼������ת��Ϊ�л������ǡ�ˮ�ȷ�Ӧ�����������ڵ��¸��¸�ѹ������ͨ��ˮ�ȷ�Ӧ������ʯ�͡�ú�ȿ�����Դ������˵������ȷ���ǣ� ��
| A��������̼�볬�ٽ�ˮ�����������͵ķ�Ӧ�����ڷ��ȷ�Ӧ |
| B����ˮ�ȷ�Ӧ����һ�ָ��ӵ�������ѧ�仯 |
| C���������糧�������÷��ȣ���������̼ת��Ϊ��Դ���� |
| D�����ſƼ��Ľ�������ˮ�ȷ�Ӧ����ȡ��Դ����ʵ�ֵ�����̼��Դ�ĺ�гѭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪��H+(aq)+OH-(aq) ��H2O(l)�� ��H��-57��3 kJ��mol-1���ֽ�һ������ϡ���ᡢŨ���ᡢϡ����ֱ��1L 1mol��L-1��NaOH��Һǡ����ȫ��Ӧ���䷴Ӧ�ȷֱ�Ϊ��H1����H2����H3��,���H1����H2�͡�H3�Ĵ�С��ϵΪ
| A����H1����H2 | B����H2����H1 |
| C����H3����H2 | D����H1����H3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ����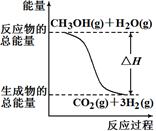
��CH3OH(g)��H2O(g)��CO2(g)��3H2(g) ?��H ����49.0 kJ/mol
��CH3OH(g)��1/2O2(g)��CO2(g)��2H2(g) ?��H����192.9 kJ/mol
����������Ӧ������˵����ȷ����( )
| A����Ӧ���е������仯����ͼ��ʾ |
| B��CH3OHת���H2�Ĺ���һ��Ҫ�������� |
| C��1 mol CH3OH���ȼ�շų�������Ϊ192.9 kJ |
| D������֪2H2(g)��O2(g)��2H2O(g)??H����483.8 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪H2O(g)�� H2O(l) ��H1��Q1 kJ��mol
C2H5OH(g) �� C2H5OH(l), ��H2��Q2 kJ��mol
C2H5OH(g)+3O2(g) ��2CO2(g) + 3H2O(g), ��H3��Q3 kJ��mol
��ʹ��23 g�ƾ�Һ����ȫȼ�գ����ָ������£���ų�������Ϊ�� ��kJ
| A��Q1 +Q2 +Q3���������� | B��0��5��Q1 +Q2 +Q3�� |
| C��0��5Q1 �C0��5Q2 +0��5Q3������ | D��1��5Q1 �C0��5Q2 +0��5Q 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�й��Ȼ�ѧ����ʽ��д���Ӧ��������ȷ���ǣ� ��
| A��ϡ������0.1 mol��L-1NaOH��Һ��Ӧ��H+��aq��+OH����aq��= H2O��l�� ��H =" -57.3" kJ��mol-1 |
| B����101KPa��������ȼ���ȡ�H =��285��5 kJ��mol-1�� ��ˮ�ֽ���Ȼ�ѧ����ʽ�� 2H2O��l��=2H2��g��+O2��g����H = +285��5 kJ��mol-1 |
| C����֪2C��s��+O2��g��=2CO��g����H=��221 kJ��mol-1�� ���֪C��ȼ����Ϊ110.5 kJ��mol-1 |
| D��1mol������ȫȼ������Һ̬ˮ����Ϊ285.8kJ��������ȼ�յ��Ȼ�ѧ����ʽΪ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����й��Ȼ�ѧ����ʽ�������У���ȷ���� �� ��
| A����20.0g NaOH��ϡ��Һ��������ϡ������ȫ�кͣ��ų�28��7kJ�����������ʾ��[���ȵ��Ȼ�ѧ����ʽΪ2NaOH��aq����H2SO4��aq����Na2SO4��aq����2H2O��l����H����114��8kJ��mol |
B����֪�Ȼ�ѧ����ʽ��SO2��g����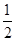 O2��g�� O2��g�� SO3��g�� ��H����98��32kJ��mol���������г���2molSO2��1molO2��ַ�Ӧ�����շų�������Ϊ196��64kJ SO3��g�� ��H����98��32kJ��mol���������г���2molSO2��1molO2��ַ�Ӧ�����շų�������Ϊ196��64kJ |
| C����֪2H2��g����O2��g����2H2O��g���� ��H����483��6kJ��mol����H2��ȼ����Ϊ241��8kJ��mol |
| D����֪��S��s����O2��g����SO2��g���� ��H1��S��g��ʮO2��g����SO2��g������H2 ���H1����H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����Ȼ�ѧ����ʽ��ȷ���ǣ���H�ľ���ֵ����ȷ���� ��
| A��C2H5OH(l)+3O2(g)=2CO2(g)��3H2O(g)��H��-1367��0kJ��mol-1(ȼ����) |
| B��NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)��H=+57��3kJ��mol-1(���) |
| C��S(s)+O2(g)=SO2(g)��H=-269��8kJ��mol-1(��Ӧ��) |
| D��2NO2=2NO+O2��H=+116��2kJ��mol-1(��Ӧ��) |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com