
| A. | ⑥⑤④①③② | B. | ⑥④⑤②①③ | C. | ⑥④①③⑤② | D. | ②⑥④①③⑤ |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
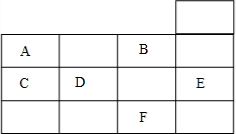
| A. | 常压下六种元素的单质中,F单质的沸点最高 | |
| B. | 晶体E中不存在化学键 | |
| C. | D元素的非金属性比B元素的非金属性强 | |
| D. | 单质A、C均没有同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基的电子式: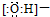 | B. | 硫原子的原子结构示意图: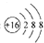 | ||
| C. | 乙烯分子的实验式:C2H4 | D. | 3,3一二甲基一1一戊烯的键线式: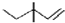 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | B. | 2Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn | ||
| C. | 2MgO$\frac{\underline{\;电解\;}}{\;}$2Mg+O2↑ | D. | 4CO+Fe3O4$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有自发进行的化学反应都是放热反应 | |
| B. | 同一物质固、液、气三种状态的熵值相同 | |
| C. | △H<0、△S>0的反应可自发进行 | |
| D. | 在其他条件不变的情况下,使用催化剂可以改变化学反应进行的方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
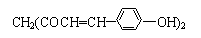 ,用它制成的试剂可以检验物质的酸碱性.能够跟1mol该化合物起反应的Br2(水溶液)或H2的最大用量分别是( )
,用它制成的试剂可以检验物质的酸碱性.能够跟1mol该化合物起反应的Br2(水溶液)或H2的最大用量分别是( )| A. | 3 mol、5 mol | B. | 6 mol、8 mol | C. | 10 mol、8 mol | D. | 6 mol、10 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素(除了稀有气体元素外),从左到右,原子半径依次减小 | |
| B. | 对于第三周期元素,从钠到氯,原子半径依次减小 | |
| C. | 各元素的原子半径总比其离子半径大 | |
| D. | 阴离子的半径大于其原子半径,阳离子的半径小于其原子半径 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com