
| A. | 同周期元素(除了稀有气体元素外),从左到右,原子半径依次减小 | |
| B. | 对于第三周期元素,从钠到氯,原子半径依次减小 | |
| C. | 各元素的原子半径总比其离子半径大 | |
| D. | 阴离子的半径大于其原子半径,阳离子的半径小于其原子半径 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ⑥⑤④①③② | B. | ⑥④⑤②①③ | C. | ⑥④①③⑤② | D. | ②⑥④①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D2+>B2+>A2+>E2+ | B. | B2+>A2+>D2+>E2+ | C. | D2+>E2+>A2+>B2+ | D. | E2+>B2+>A2+>D2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在某恒容的密闭容器中,可逆反应A(g)+B(g)?xC(g)有如图所示的关系曲线,下列说法正确的是( )
在某恒容的密闭容器中,可逆反应A(g)+B(g)?xC(g)有如图所示的关系曲线,下列说法正确的是( )| A. | 温度:T1>T2 | B. | 压强:p1>p2 | ||
| C. | 正反应是放热反应 | D. | x的值是2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 丙烯酸和油酸互为同系物 | |
| B. | 淀粉和纤维素互为同分异构体 | |
| C. | CuSO4浓溶液能使蛋白质溶液发生盐析 | |
| D. | 麦芽糖和脂肪在一定条件下都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
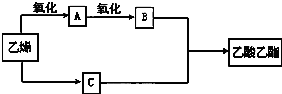
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 96% | B. | 48% | C. | 9.6% | D. | 56% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com