
| A. | 丙烯酸和油酸互为同系物 | |
| B. | 淀粉和纤维素互为同分异构体 | |
| C. | CuSO4浓溶液能使蛋白质溶液发生盐析 | |
| D. | 麦芽糖和脂肪在一定条件下都能发生水解反应 |
分析 A.根据同系物的定义判断;
B.淀粉、纤维素的分子式不一定相同;
C.硫酸铜可使蛋白质变性;
D.麦芽糖为二糖,脂肪含有酯基,都可水解.
解答 解:A.丙烯酸CH2═CHCOOH和油酸C17H33COOH分子中都含有官能团羧基,它们的烃基中都只含有一个不饱和的碳碳双键,所以二者分子结构相似,并且在组成上相差15个-CH2,完全符合同系物的定义,故二者属于同系物,故A正确;
B.淀粉、纤维素都为高聚物,n介于较大的范围之间,不确定,则二者的分子式不一定相同,则不是同分异构体,故B错误;
C.硫酸铜为重金属盐,可使蛋白质变性,故C错误;
D.麦芽糖为二糖,可水解生成葡萄糖,脂肪含有酯基,可水解生成高级脂肪酸和甘油,故D正确.
故选AD.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重糖类、蛋白质的考查,注意把握有机物的相关概念的理解和运用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | B. | 2Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn | ||
| C. | 2MgO$\frac{\underline{\;电解\;}}{\;}$2Mg+O2↑ | D. | 4CO+Fe3O4$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素(除了稀有气体元素外),从左到右,原子半径依次减小 | |
| B. | 对于第三周期元素,从钠到氯,原子半径依次减小 | |
| C. | 各元素的原子半径总比其离子半径大 | |
| D. | 阴离子的半径大于其原子半径,阳离子的半径小于其原子半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 洗去沾在手上的敌敌畏用碱性肥皂较好 | |
| B. | 洗去沾在手上的敌敌畏用中性香皂较好 | |
| C. | 敌敌畏极易溶于水 | |
| D. | 敌敌畏可以发生加成反应,不能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
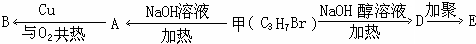
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com