
| A. | 该金刚石粉末与水混和后能产生丁达尔现象 | |
| B. | 该反应属于置换反应 | |
| C. | CCl4和CH4在常温下均为无色气体 | |
| D. | 金刚石属于非金属单质 |
分析 A.分散质微粒直径在1-100nm(10-9~10-7m)之间是胶体,有丁达尔效应;
B.单质和化合物反应生成单质和化合物为置换反应;
C.CH4在常温下为无色气体,CCl4在常温下均为无色液体;
D.一般的单质还金字旁的是金属,带气字头的是气态单质,带石字旁、三点水旁的是固态或液态非金属.
解答 解:A.纳米级金刚石粉末(粉末直径为10-9~10-7m)的颗粒,该金刚石粉末与水混和形成胶体,能产生丁达尔现象,故A正确;
B.CCl4和金属钠反应的方程式为:CCl4+4Na$\frac{\underline{\;△\;}}{\;}$C+4NaCl,此反应是置换反应,故B正确;
C.CH4在常温下为无色气体,CCl4在常温下均为无色液体,是常用的有机溶剂,故C错误;
D.金刚石是碳元素组成的单质,带石字旁,属于非金属单质,故D正确;
故选C.
点评 本题考查学生所学过的基本概念,掌握胶体、置换反应、CCl4和CH4颜色、非金属单质等知识是解答关键,题目难度不大.


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:填空题
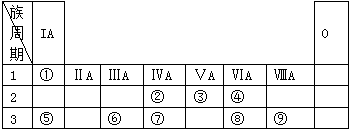
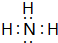 ;W与④的单质在催化剂、加热条件下发生的反应是工业制取Z的基础,写出该反应的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
;W与④的单质在催化剂、加热条件下发生的反应是工业制取Z的基础,写出该反应的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如表和如图表示:下列说法正确的是( )
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如表和如图表示:下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
| A. | 10min内甲容器中反应的平均速率v(A)=0.025mol/(L•min) | |
| B. | 由图可知:T1<T2,且该反应为吸热反应 | |
| C. | x=1,若平衡时保持温度不变,改变容器体积平衡移动 | |
| D. | T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为75% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验现象 | 结论 | |
| ① | 通电后,铁棒和石墨棒上都有气泡冒出 | |
| ② | 将阴极上方收集的气体靠近火焰,有爆鸣声 | |
| ③ | 阳极收集到的气体呈黄绿色,可使湿润的淀粉KI试纸变蓝 | |
| ④ | 铁棒一端的溶液滴加酚酞后变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙跟稀盐酸反应CO32-+2H+=CO2↑+H2O | |
| B. | 向碳酸钠溶液中加入过量醋酸溶液CO32-+2H+=CO2↑+H2O | |
| C. | 氯气与水反应Cl2+H2O=2H++Cl-+ClO- | |
| D. | 三氯化铝溶液与氨水Al3++3NH3•H2O=Al(OH)3↓+3NH4 + |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
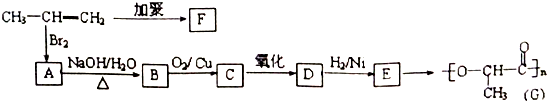
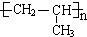 .
.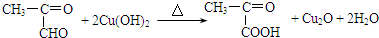 .
.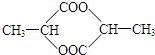 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com