
����Ŀ��ʵ�����ú�������(FeO��Fe2O3)�ķ�CuO�Ʊ��������徭�����й���(��֪��Fe3+��pH=5ʱ����ȫ����)��
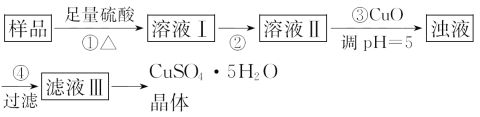
���з�����ȷ����( )
A.��98%��Ũ���������ܽ����õ�4.5 mol��L-1��ϡ���ᣬ��4�ֲ�������
B.�����Ŀ���ǽ���Һ���е�Fe2+���ת����Fe3+��ʵ�����������Һ����ͨ������������
C.����Cu(OH)2���CuOҲ�ɵ�����ҺpH����Ӱ��ʵ����
D.�����֮���ʵ������������ܼ��ᾧ�������������������������ƾ��ơ������ǡ����ż�
���𰸡�C
��������ѡC����Ũ��������һ�����ʵ���Ũ�ȵ�ϡ������Һ����ʹ����Ͳ��ȡŨ�����������ܽ������Ҫ�ձ��Ͳ���������Ҫ�õ�����ƿ�ͽ�ͷ�ιܣ�A�������������Fe2+��ѡ��Cl2�����������Եõ������ĵ������壬���������ѡ��H2O2��B�������֮��Ҫ�õ��������壬Ӧͨ����������Ũ������ȴ�ᾧ�ķ�����������������Ҫ�����ǣ����ż�Ҳ�ɸ�Ϊ����̨����Ȧ��D����


 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M��G����Ԫ�ط������������ڣ���ԭ��������������X��Zͬ���壬���γ����ӻ�����ZX��Y��Mͬ���壬���γ�MY2��MY3���ַ��ӡ��ش��������⣺
��1��Y��Ԫ�����ڱ��е�λ��Ϊ_____________________________.
��2������Ԫ�ص�����������Ӧ��ˮ����������ǿ����_____________________(д��ѧʽ)���ǽ�����̬�⻯�ﻹԭ����ǿ����_______________(д��ѧʽ)��
��3��Y��G�ĵ��ʻ���Ԫ��֮���γɵĻ��������ˮ����������__________________(д�������������ʵĻ�ѧʽ)��
��4��ZX�ĵ���ʽΪ_________________��ZX��ˮ��Ӧ�ų�����Ļ�ѧ����ʽΪ__________________��
��5����XԪ�صĵ�����YԪ�صĵ��ʼ���X��Y��Z����Ԫ����ɵĻ��������Һ����ȼ�ϵ�أ�д���õ�صĵ缫��Ӧʽ������____________������__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����������Һ��ɷ��������������ӷ�Ӧ��
Ce4����Fe2��===Fe3����Ce3����Sn2����2Fe3��===2Fe2����Sn4��
�ɴ˿���ȷ��Fe3����Ce4����Sn4���������ӵ���������ǿ������˳��( )
A. Sn4����Fe3����Ce4�� B. Sn4����Ce4����Fe3��
C. Ce4����Fe3����Sn4�� D. Fe3����Sn4����Ce4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ұ������һ�����������ַ������� ��̿�� �� ˮú������CO����![]() ���� �� ���ý����û��� �� ��ⷨ�����ַ����ڹ�ҵ�Ͼ���Ӧ�á��Ŵ��У���1�����տ�ȸʯ��ͭ����2��ʪ����ͭ���ִ��У���3�����ȷ���������4���ӹ�±ʯ����þ�����ж����ǵ�ұ�������ķ�������ȷ���ǣ� ��
���� �� ���ý����û��� �� ��ⷨ�����ַ����ڹ�ҵ�Ͼ���Ӧ�á��Ŵ��У���1�����տ�ȸʯ��ͭ����2��ʪ����ͭ���ִ��У���3�����ȷ���������4���ӹ�±ʯ����þ�����ж����ǵ�ұ�������ķ�������ȷ���ǣ� ��
A. ��1���� B. ��2���� C. ��3���� D. ��4����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��1��Ҫ����������Һ������ ��ȡ12.5 mol/L��Ũ���� mL��
��2�����ƹ����У�����1������ѡ�������Լ��ձ�������������ͷ�ι���,�����õ��������� ��
��3��A��B��������Һʱ�����õ��Ķ���������һ���֣�������ṩ���龰��Ҫ��ش����⡣
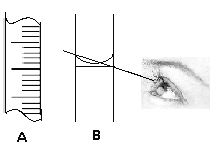
����B�����߹۲�Һ�棬����Ҫ�������еIJ����� ���˲������ʱ��������Һ��Ũ�� ����ƫ�ߡ�ƫ�͡��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӱ�������ĺ��ǡ��У�Ϊ�ñ����ĺ��սʿ����ʳ�Σ��˶��ӽ���ʳ��ˮ���ް��������ϣ�����ɽ�У������˶�����ʵ�����У�����ʳ��ˮ����ȡ��ʳ�Σ����õ���÷����ǣ� ��
A������ B������ C����ȡ D������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ǿ�����ɫ��Һ�У����и��������ܴ����������( )
A. K+��Na+��NO3-��Br- B. Na+��NH4+��NO3-��Cl-
C. K+��Na+��HCO3- ��NO3- D. K+��Cu2+��Cl-��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ӿ�������Ҫ�������͡����й������ǵ�˵������ȷ����
A. ������������Ӿ��嶼�ܵ���
B. ��þ��������1��Mg2+ֻ��2���۵��Ӵ���ǿ�ҵ������
C. ������������Ӿ��嶼�ɲ�ȡ���ܶѻ���ʽ
D. ������������Ӿ����зֱ���ڽ����������Ӽ���ǿ�ҵ�����ã����Ѷ��ѣ������������չ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£�����ǿ����ʵı�����Һ�д����ų����ܽ�ƽ�⣬��ƽ�ⳣ��Ϊ
���� | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp��25���� | 8.0��10��16 | 2.2��10��20 | 4.0��10��38 |
���ں�Fe2(SO4)3��FeSO4��CuSO4��0.5mol�Ļ����Һ1L�������ϱ������жϣ�˵���������
A. ������Һ����μ���NaOH��Һ�����ȿ������ɫ����
B. ����Һ�м���˫��ˮ������CuO��ĩ��pH�����˺�ɻ�ϴ�����CuSO4��Һ
C. ����Һ��һ����c��SO42������[c��Fe3+��+c��Fe2+��+c��Cu2+��]=5��4
D. ������FeCl3��ĩ���뺬Cu��OH��2������Һ�У�����c��Cu2+������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com