
【题目】今有一混合物的水溶液,含有以下离子中的若干种:Na+、NH4+、Clˉ、Ba2+、CO32ˉ、SO42ˉ,现取两份 100 m L的该溶液进行如下实验:
(1)第1份加足量NaOH溶液,加热,收集到标准状况下的气体448mL;
(2)第2份加足量Ba(OH)2溶液,得沉淀4.30 g,再用足量盐酸洗涤、干燥,得沉淀2.33 g。
根据上述实验,下列推测正确的是( )
A.Ba2+一定存在B.100 mL该溶液中含0.01 molCO32ˉ
C.Na+不一定存在D.Clˉ不确定,可向原溶液中加入AgNO3溶液进行检验
【答案】B
【解析】
第一份加足量的NaOH溶液,加热,收集到气体,该气体为NH3,即原溶液中含有NH4+,n(NH4+)=![]() =0.02mol,第2份加足量Ba(OH)2溶液,得沉淀4.30g,再用足量盐酸洗涤、干燥,得沉淀2.33g,说明原溶液中有SO42-和CO32-,n(SO42-)=
=0.02mol,第2份加足量Ba(OH)2溶液,得沉淀4.30g,再用足量盐酸洗涤、干燥,得沉淀2.33g,说明原溶液中有SO42-和CO32-,n(SO42-)=![]() =0.01mol,n(CO32-)=
=0.01mol,n(CO32-)=![]() =0.01mol,然后根据电荷守恒,确认其他,据此分析。
=0.01mol,然后根据电荷守恒,确认其他,据此分析。
第一份加足量的NaOH溶液,加热,收集到气体,该气体为NH3,即原溶液中含有NH4+,n(NH4+)=![]() =0.02mol,第2份加足量Ba(OH)2溶液,得沉淀4.30g,再用足量盐酸洗涤、干燥,得沉淀2.33g,该沉淀为BaSO4,未加盐酸前的沉淀是BaCO3和BaSO4混合物,说明原溶液中有SO42-和CO32-,因此原溶液中一定不存在Ba+,n(SO42-)=
=0.02mol,第2份加足量Ba(OH)2溶液,得沉淀4.30g,再用足量盐酸洗涤、干燥,得沉淀2.33g,该沉淀为BaSO4,未加盐酸前的沉淀是BaCO3和BaSO4混合物,说明原溶液中有SO42-和CO32-,因此原溶液中一定不存在Ba+,n(SO42-)=![]() =0.01mol,n(CO32-)=
=0.01mol,n(CO32-)=![]() =0.01mol,溶液呈现电中性,一定含有Na-。
=0.01mol,溶液呈现电中性,一定含有Na-。
A、因为原溶液中一定存在CO32-和SO42-,因此Ba2+一定不存在,故A说法错误;
B、根据上述分析,100mL溶液中含有0.01molCO32-,故B说法正确;
C、根据上述分析,原溶液中一定存在Na+,故C说法错误;
D、根据上述分析,Cl-可能存在,因为原溶液中存在SO42-和CO32-,直接加入AgNO3对检验Cl-产生干扰,需要先除去SO42-和CO32-,故D说法错误;
答案选B。


 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.最高正化合物:P>N>C
B.第一电离能:Li>Na>K
C.热稳定性:H2O>HF>H2S
D.碱性:LiOH>NaOH>KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家凯库勒认为:苯分子是由6个碳原子以单双键相互交替结合而成的环状结构为了验证凯库勒有关苯环的观点,甲同学设计了如图实验方案.

①按如图所示的装置图连接好各仪器;②检验装置的气密性;③在A中加入适量的苯和液溴的混合液体,再加入少量铁粉,塞上橡皮塞,打开止水夹K1、K2、K3;④待C中烧瓶收集满气体后,将导管b的下端插入烧杯里的水中,挤压預先装有水的胶头滴管的胶头,观察实验现象.
请回答下列问题.
(1)A中所发生反应的反应方程式为_____,能证明凯库勒观点错误的实验现象是______.
(2)装置B的作用是______.
(3)C中烧瓶的容积为500mL,收集气体时,由于空气未排尽,最终水未充满烧瓶,假设烧瓶中混合气体对氢气的相对密度为35.3,则实验结束时,进入烧瓶中的水的体积为______mL 空气的平均相对分子质量为29.
(4)已知乳酸的结构简式为![]() 试回答:
试回答:
①乳酸分子中含有______和______两种官能团写名称.
②乳酸跟氢氧化钠溶液反应的化学方程式:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是

A. 该反应进行到M点放出的热量大于进行到W点放出的热量
B. T2下,在0~t1时间内,υ(Y)=a-b/t1 mol/(L·min)
C. M点的正反应速率υ(正)大于N点的逆反应速率υ(逆)
D. M点时再加入一定量的X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用溶解、过滤、结晶的方法来分离的一组物质是 ( )
A. NaCl 和 淀粉 B. BaSO4 和 CaCO3
C. CuO 和 KCl D. Mg(NO3)2 和 I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
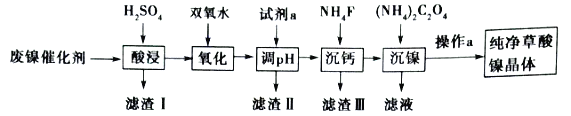
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:

②2Ksp(CaF2)=1.46×10-10
③当某物质浓度小于1.0×10-5mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:_________________________________。
(2)双氧水是一种绿色氧化剂,写出“氧化”时的离子反应方程式:______________________。
(3)试剂a“调pH”时pH的调控范围为___________,试剂a为___________(填字母)
A .Fe(OH)3 B. Fe(OH)2 C.Al(OH)3 D. Ni(OH)2 E. NaOH
(4)写出“沉钙”时的离子反应方程式:_________________________________。当Ca2+沉淀完全时,溶液中c(F-)>___________mol·L-1(写出计算式即可)。证明Ni2+已经沉淀完全的实验操作及现象是_________________________________。
(5)操作a的内容是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、量筒、泡沫塑料、泡沫塑料板、胶头滴管、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是______、_______________。他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50 mL0.55 mol·L-1NaOH溶液 | 50 mL0.5mol·L-1HCl溶液 | 20 ℃ | 23.3 ℃ | |
② | 50 mL0.55 mol·L-1NaOH溶液 | 50 mL0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.5 ℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
(2)NaOH用量比HCl用量稍多的原因是_________________________________。
(3)根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: ___________________。
(4)若用KOH代替NaOH,对测定结果________(填“有”或 “无”)影响;若用醋酸代替HCl做实验,对测定结果__________(填“有”或“无”)影响。
(5)两溶液混合后,怎样搅拌溶液_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组学生用50 mL 0.50 mol·L1盐酸与50 mL 0.55 mol·L1 NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中放出的热量计算中和热。下列说法正确的是

A. 实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯间填满碎泡沫塑料的作用是固定小烧杯
D. 酸或碱的物质的量越大,所测中和热的数值越大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com