
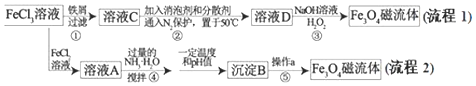
【题目】纳米磁性流体材料广泛应用于减震、医疗器械、声音调节等高科技领域.如图是制备纳米![]() 磁流体的两种流程:
磁流体的两种流程:
![]() 分析流程图中的两种流程,其中______
分析流程图中的两种流程,其中______![]() 填“流程1”、“流程2”
填“流程1”、“流程2”![]() 所有反应不涉及氧化还原反应.步骤
所有反应不涉及氧化还原反应.步骤![]() 反应的离子方程式为______.
反应的离子方程式为______.
![]() 步骤
步骤![]() 保持
保持![]() 的方法是______.
的方法是______.
![]() 步骤
步骤![]() 中加入的
中加入的![]() 电子式是______,步骤
电子式是______,步骤![]() 制备
制备![]() 磁流体的化学方程式为______.
磁流体的化学方程式为______.
![]() 流程2中
流程2中![]() 和
和![]() 制备
制备![]() 磁流体,理论上
磁流体,理论上![]() 和
和![]() 物质的量之比为______
物质的量之比为______![]() 己知沉淀B为四氧化三铁.步骤
己知沉淀B为四氧化三铁.步骤![]() 中操作a具体的步骤是______.
中操作a具体的步骤是______.
![]() 利用
利用![]() 可测定
可测定![]() 磁流体中的
磁流体中的![]() 含量.若
含量.若![]() 磁流体与
磁流体与![]() 充分反应消耗了
充分反应消耗了![]() 的
的![]() 标准溶液100mL,则磁流体中含有
标准溶液100mL,则磁流体中含有![]() 的物质的量为______mol.
的物质的量为______mol.
【答案】流程2 ![]() 水浴加热
水浴加热 ![]()
![]() 2:l 过滤、洗涤、干澡
2:l 过滤、洗涤、干澡 ![]()
【解析】
氯化铁溶液中加入铁屑过滤得到溶液C为氯化亚铁溶液,加入消泡剂和分散剂通入氮气保护置于50°C容器中得到溶液D,加入氢氧化钠溶液和过氧化氢得到磁性氧化铁,氯化铁和氯化亚铁混合溶液A加入过量氨水搅拌在一定温度和pH条件下生成沉淀B为四氧化三铁,经过滤、洗涤、干澡可得到磁性氧化铁;
(1)流程1中存在铁和氯化铁反应为氧化还原反应,流程2中发生的是复分解反应;步骤①反应为铁还原铁离子生成亚铁离子;
(2)温度低于100°C的加热条件可以用水浴加热;
(3)过氧化氢为共价化合物,具有氧化性,在氢氧化钠溶液中和氯化亚铁反应生成四氧化三铁、氯化钠和水;
(4)流程2中FeCl3和FeCl2制备Fe3O4磁流体,四氧化三铁可以看做Fe2O3FeO,结合元素守恒判断;
(5)用K2Cr2O7可测定Fe3O4磁流体中的Fe2+含量,K2Cr2O7被还原成Cr3+,依据反应的离子方程式Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O的定量关系计算。
![]() 氯化铁和铁反应生成醋酸氯化亚铁,反应的离子方程式
氯化铁和铁反应生成醋酸氯化亚铁,反应的离子方程式![]() ,所以流程1中一定存在氧化还原反应,流程2中,溶液A为氯化铁和氯化亚铁的混合溶液加入氨水生成氢氧化铁、氢氧化亚铁,经过操作最后得到四氧化三铁,过程中无元素化合价变化,流程2无氧化还原反应,步骤
,所以流程1中一定存在氧化还原反应,流程2中,溶液A为氯化铁和氯化亚铁的混合溶液加入氨水生成氢氧化铁、氢氧化亚铁,经过操作最后得到四氧化三铁,过程中无元素化合价变化,流程2无氧化还原反应,步骤![]() 反应为铁还原铁离子生成亚铁离子,反应的离子方程式为:
反应为铁还原铁离子生成亚铁离子,反应的离子方程式为:![]() ;
;
![]() 步骤
步骤![]() 中,若要保持
中,若要保持![]() 的温度,操作方法是:将反应装安放在水浴中加热;
的温度,操作方法是:将反应装安放在水浴中加热;
![]() 过氧化氢为共价化合物,电子式为
过氧化氢为共价化合物,电子式为![]() ,步骤
,步骤![]() 制备
制备![]() 磁流体,是过氧化氢在氢氧化钠溶液中和氯化亚铁反应生成四氧化三铁、氯化钠和水,反应的化学方程式为:
磁流体,是过氧化氢在氢氧化钠溶液中和氯化亚铁反应生成四氧化三铁、氯化钠和水,反应的化学方程式为:![]() ;
;
![]() 流程2中
流程2中![]() 和
和![]() 制备
制备![]() 磁流体,四氧化三铁可以看做
磁流体,四氧化三铁可以看做![]() ,理论上
,理论上![]() 和
和![]() 物质的量之比为2:1,氯化铁和氯化亚铁混合溶液A加入过量氨水搅拌在一定温度和pH条件下生成沉淀B为四氧化三铁,经过滤、洗涤、干澡可得到磁性氧化铁;
物质的量之比为2:1,氯化铁和氯化亚铁混合溶液A加入过量氨水搅拌在一定温度和pH条件下生成沉淀B为四氧化三铁,经过滤、洗涤、干澡可得到磁性氧化铁;
![]() 反应的离子方程式为
反应的离子方程式为![]() ,
,![]() ,则磁流体中含有
,则磁流体中含有![]() 的物质的量为
的物质的量为![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为_________(填标号)。C、D中有气泡冒出,并可观察到的现象分别为_______________。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题小组合成了一种复合材料的基体M的结构简式为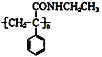 ,合成路线如下
,合成路线如下
![]()
已知:R—CN![]() R—COOH
R—COOH
请回答下列问题:
![]() 有机物C分子结构中含有的官能团有______________。
有机物C分子结构中含有的官能团有______________。
![]() 写出A的结构简式 _________________。
写出A的结构简式 _________________。
![]() 反应①、②的反应类型分别为 _______________、 ________________。
反应①、②的反应类型分别为 _______________、 ________________。
![]() 写出反应③的化学方程式 ________________。
写出反应③的化学方程式 ________________。
![]() 写出符合下列条件:①能使
写出符合下列条件:①能使![]() 溶液显紫色;②只有二个取代基;③与新制的
溶液显紫色;②只有二个取代基;③与新制的![]() 悬浊液混合加热,有砖红色沉淀生成;有机物B的一种同分异构体的结构简式 _____________。
悬浊液混合加热,有砖红色沉淀生成;有机物B的一种同分异构体的结构简式 _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为检验某溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作.其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能得到的正确结论是![]()
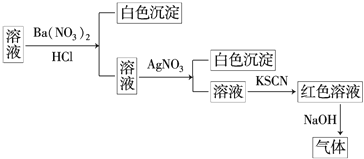
A.原溶液中一定含有![]() B.原溶液中一定含有
B.原溶液中一定含有![]()
C.原溶液中一定含有![]() D.原溶液中一定含有
D.原溶液中一定含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L某溶液A中存在![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的五种离子,浓度均为
中的五种离子,浓度均为![]() 对A溶液进行以下实验,整个过程如图所示
对A溶液进行以下实验,整个过程如图所示![]() 部分产物省略
部分产物省略![]() ,反应
,反应![]() 后的溶液B与溶液A中的阴离子种类相同。下列结论正确的是
后的溶液B与溶液A中的阴离子种类相同。下列结论正确的是![]()
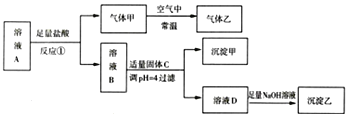
A.溶液B中存在的阴离子是![]() 、
、![]() 、
、![]()
B.固体C可能是MgO、![]() 或
或![]()
C.沉淀甲是![]() 、沉淀乙是
、沉淀乙是![]()
D.A中不能确定的离子是![]() 、
、![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大庆市某中学化学实验小组在实验室鉴定某无色溶液.已知溶液中的溶质仅由![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种组成.取该溶液进行如下实验:
中的若干种组成.取该溶液进行如下实验:
![]() 取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液
取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液
![]() 在
在![]() 所得溶液中加入过量
所得溶液中加入过量![]() 溶液,有气体生成,同时产生白色沉淀甲;
溶液,有气体生成,同时产生白色沉淀甲;
![]() 在
在![]() 所得溶液中加入过量
所得溶液中加入过量![]() 溶液并加热也有气体生成,同时产生白色沉淀乙
溶液并加热也有气体生成,同时产生白色沉淀乙
则下列离子在原溶液中一定存在的有![]()
A.![]() 、
、![]() 、
、![]() B.
B.![]() 、
、![]() 、
、![]() 、
、![]() 、
、
C.![]() 、
、![]() 、
、![]() D.
D.![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上最大的钨储藏国,金属钨可用于制造灯丝、合金钢和光学仪器,有“光明使者”的美誉,现以白钨矿(主要成分为CaWO4,还含有二氧化硅、氧化铁等杂质)为原料冶炼高纯度金属钨,工业流程如图:
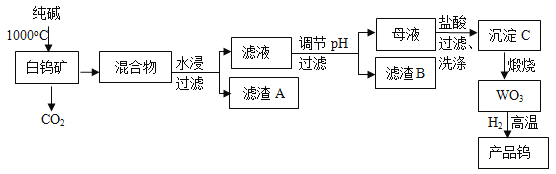
已知:①钨酸酸性很弱,难溶于水;
②完全沉淀离子的pH值:SiO32﹣为8,WO42﹣为5;
③碳和金属钨在高温下会反应生成碳化钨。
回答下列问题:
(1)工业上生产纯碱常先制得碳酸氢钠,此法叫“联碱法”,为我国化工专家侯德榜创立,即向饱和食盐水中先通入NH3,再通入CO2,最终生成碳酸氢钠晶体和氯化铵溶液,写出该化学反应方程式:____。
(2)流程中白钨矿CaWO4和纯碱发生的化学反应方程式是:____。
(3)滤渣B的主要成分是(写化学式)___。调节pH可选用的试剂是:__(填选项)。
A.氨水 B.盐酸 C.NaOH溶液 D.Na2CO3溶液
(4)检验沉淀C已经洗涤干净的操作是____。
(5)为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂的原因是:___。
(6)将氢氧化钙加入钨酸钠碱性溶液中可得到钨酸钙,已知某温度时,Ksp(CaWO4)=1×10﹣10,Ksp[Ca(OH)2]=4×10﹣7,当溶液中WO42﹣恰好沉淀完全(离子浓度等于10﹣5mol/L)时,溶液中c(OH﹣)=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4molA和 2molB进行如下反应:3A(g)+2B(g)![]() 4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
A.该反应的化学平衡常数表达式是 K=![]()
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加 B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种离子,该小组同学取100mL水样进行实验:向样品中先滴加氯化钡溶液,再滴加
中的若干种离子,该小组同学取100mL水样进行实验:向样品中先滴加氯化钡溶液,再滴加![]() 盐酸,实验过程中沉淀质量的变化如图所示.下列说法正确的是
盐酸,实验过程中沉淀质量的变化如图所示.下列说法正确的是![]()
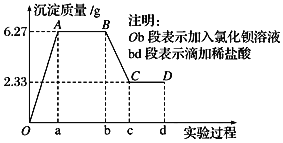
A.水样中一定不存在![]() 、
、![]() ,可能存在
,可能存在![]()
B.水样中一定存在![]() 、
、![]() 、
、![]()
C.BC段曲线所表示的离子方程式为![]()
D.水样中一定存在![]() ,且
,且![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com