
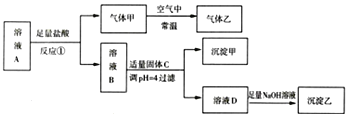
【题目】1L某溶液A中存在![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的五种离子,浓度均为
中的五种离子,浓度均为![]() 对A溶液进行以下实验,整个过程如图所示
对A溶液进行以下实验,整个过程如图所示![]() 部分产物省略
部分产物省略![]() ,反应
,反应![]() 后的溶液B与溶液A中的阴离子种类相同。下列结论正确的是
后的溶液B与溶液A中的阴离子种类相同。下列结论正确的是![]()
A.溶液B中存在的阴离子是![]() 、
、![]() 、
、![]()
B.固体C可能是MgO、![]() 或
或![]()
C.沉淀甲是![]() 、沉淀乙是
、沉淀乙是![]()
D.A中不能确定的离子是![]() 、
、![]() 和
和![]()
【答案】A
【解析】
由实验可知,向A溶液中加入足量的盐酸,有气体生成,且常温下气体甲与空气反应生成气体乙,可知甲为NO、乙为![]() ;反应
;反应![]() 后的溶液B与溶液A中的阴离子种类相同,说明反应后的溶液中的阴离子的种类没有变化,结合整个过程可知:加入盐酸而反应后的溶液中的阴离子的种类没有变化则原溶液中一定含有
后的溶液B与溶液A中的阴离子种类相同,说明反应后的溶液中的阴离子的种类没有变化,结合整个过程可知:加入盐酸而反应后的溶液中的阴离子的种类没有变化则原溶液中一定含有![]() ,一定没有
,一定没有![]() 和
和![]() ;有气体生成则含有
;有气体生成则含有![]() 和
和![]() ;一共有五种离子,且浓度均为
;一共有五种离子,且浓度均为![]() ,
,![]() 、
、![]() 、
、![]() 正好电荷守恒。说明存在的另外两种离子的带电量相同,应为
正好电荷守恒。说明存在的另外两种离子的带电量相同,应为![]() 和
和![]() ,则不含
,则不含![]() 、
、![]() 、
、![]() ,综上所述,溶液中存在的五种离子为:
,综上所述,溶液中存在的五种离子为:![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() ,以此来解答。
,以此来解答。
由上述分析可知,溶液中存在的五种离子为:![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() ,
,
A.由以上分析可知,溶液B中存在的阴离子是![]() 、
、![]() 、
、![]() ,选项A正确;
,选项A正确;
B.![]() 不能调节溶液的pH,固体C不可能是
不能调节溶液的pH,固体C不可能是![]() ,选项B错误;
,选项B错误;
C.沉淀甲是![]() ,沉淀乙是
,沉淀乙是![]() ,选项C错误;
,选项C错误;
D.由以上分析可知,一定有![]() ,没有
,没有![]() 、
、![]() ,选项D错误;
,选项D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】有M、N、P、E、F五种金属,已知:①![]() ;②M、P用导线连接并放入硫酸氢钠溶液中,M表面有大量气泡逸出;③N、E用导线连接并放入E的硫酸盐溶液中,其中一极的电极反应式为
;②M、P用导线连接并放入硫酸氢钠溶液中,M表面有大量气泡逸出;③N、E用导线连接并放入E的硫酸盐溶液中,其中一极的电极反应式为![]() ;④P、F组成原电池时,F发生氧化反应。则这五种金属的还原性顺序是( )
;④P、F组成原电池时,F发生氧化反应。则这五种金属的还原性顺序是( )
A.F>P>M>N>EB.E>N>M>P>F
C.P>F>N>M>ED.E>P>F>M>N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是茉莉香精油的主要成分,结构简式是![]() ,以烃A和烃D为原料合成M的流程如下
,以烃A和烃D为原料合成M的流程如下![]() 部分反应条件未注明
部分反应条件未注明![]() :
:
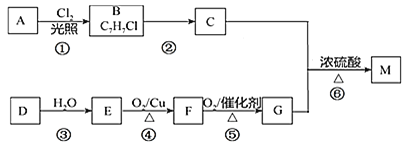
⑴写出D的电子式______。
⑵在①⑥的转化中属于取代反应的有______加成反应的有______。
⑶写出②、④的反应方程式______、______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离平衡常数是衡量弱电解质电离程度的物理量。
I.已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(1)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为________(用化学式表示)。
(2)向NaCN溶液中通入少量的CO2,发生反应的化学方程式__________________。
(3)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________ mol·L-1(填精确值),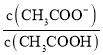 =_____。
=_____。
П.常温下有0.1 mol/L的以下几种溶液,①H2SO4溶液,②NaHSO4溶液,③CH3COOH溶液,④HCl溶液,⑤HCN溶液,⑥NH3·H2O,其中如下几种溶液的电离度(即已经电离的占原来总的百分数)如下表(已知H2SO4的第一步电离是完全的),回答下面问题:

(4)常温下,pH相同的表格中几种溶液,其物质的量浓度由大到小的顺序是(填序号,下同)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中可能含有下列离子中的若干种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,现取三份20mL该溶液进行如下实验:
,现取三份20mL该溶液进行如下实验:
![]() 第一份加入足量盐酸,无任何气体产生
第一份加入足量盐酸,无任何气体产生
![]() 第二份加入足量NaOH溶液,经搅拌、过滤、洗涤、灼烧,最后得到xg固体
第二份加入足量NaOH溶液,经搅拌、过滤、洗涤、灼烧,最后得到xg固体
![]() 第三份滴加
第三份滴加![]() 酸性
酸性![]() 溶液,恰好完全反应,消耗其体积为VmL
溶液,恰好完全反应,消耗其体积为VmL
![]() 另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色
另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色
根据上述实验,以下说法正确的是![]()
A.由实验![]() 、
、![]() 可判定原混合溶液中是否存在
可判定原混合溶液中是否存在![]()
B.由实验![]() 可推断原混合溶液中是否含有
可推断原混合溶液中是否含有![]()
C.由实验![]() 可判定原混合溶液中是否含有
可判定原混合溶液中是否含有![]()
D.原混合溶液中只存在![]() 、
、![]() 、
、![]() ,不可能存在
,不可能存在![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米磁性流体材料广泛应用于减震、医疗器械、声音调节等高科技领域.如图是制备纳米![]() 磁流体的两种流程:
磁流体的两种流程:
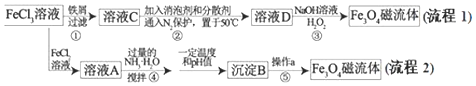
![]() 分析流程图中的两种流程,其中______
分析流程图中的两种流程,其中______![]() 填“流程1”、“流程2”
填“流程1”、“流程2”![]() 所有反应不涉及氧化还原反应.步骤
所有反应不涉及氧化还原反应.步骤![]() 反应的离子方程式为______.
反应的离子方程式为______.
![]() 步骤
步骤![]() 保持
保持![]() 的方法是______.
的方法是______.
![]() 步骤
步骤![]() 中加入的
中加入的![]() 电子式是______,步骤
电子式是______,步骤![]() 制备
制备![]() 磁流体的化学方程式为______.
磁流体的化学方程式为______.
![]() 流程2中
流程2中![]() 和
和![]() 制备
制备![]() 磁流体,理论上
磁流体,理论上![]() 和
和![]() 物质的量之比为______
物质的量之比为______![]() 己知沉淀B为四氧化三铁.步骤
己知沉淀B为四氧化三铁.步骤![]() 中操作a具体的步骤是______.
中操作a具体的步骤是______.
![]() 利用
利用![]() 可测定
可测定![]() 磁流体中的
磁流体中的![]() 含量.若
含量.若![]() 磁流体与
磁流体与![]() 充分反应消耗了
充分反应消耗了![]() 的
的![]() 标准溶液100mL,则磁流体中含有
标准溶液100mL,则磁流体中含有![]() 的物质的量为______mol.
的物质的量为______mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种常见的强氧化剂,主要用于防腐、化工、制药等。现以某种软锰矿
是一种常见的强氧化剂,主要用于防腐、化工、制药等。现以某种软锰矿![]() 主要成分
主要成分![]() ,还有
,还有![]() 、
、![]() 、
、![]() 等
等![]() 作脱硫剂,通过如下简化流程既脱除燃煤尾气中的
作脱硫剂,通过如下简化流程既脱除燃煤尾气中的![]() ,又制得
,又制得![]() 反应条件已经省略
反应条件已经省略![]() 。
。
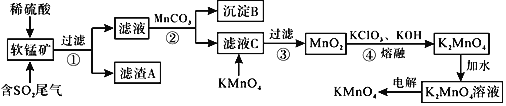
已知:![]() ,
,![]() 回答下列问题:
回答下列问题:
![]() 滤渣A的成分是
滤渣A的成分是![]() 写化学式
写化学式![]() ______。
______。
![]() 析出沉淀B时,首先析出的物质是
析出沉淀B时,首先析出的物质是![]() 写化学式
写化学式![]() ______。
______。
![]() 步骤2中加入
步骤2中加入![]() 的作用为______。
的作用为______。
![]() 滤液C中加入
滤液C中加入![]() 时发生反应的离子方程式是______。
时发生反应的离子方程式是______。
![]() 完成步骤4中反应的化学方程式______
完成步骤4中反应的化学方程式______![]() ______
______![]() ______
______![]() ______
______

![]() 电解制备
电解制备![]() 的装置如图所示。电解液中最好选择______离子交换膜
的装置如图所示。电解液中最好选择______离子交换膜![]() 填“阳”或“阴”
填“阳”或“阴”![]() 。电解时,阳极的电极反应式为______。
。电解时,阳极的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)乙炔的电子式_______。
(2)某气态有机物相对于氢气的密度为 14,则其结构简式为_______。
(3)某有机物的结构简式如图所示,则其一氯代物共有_______种。
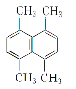
(4)有机物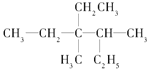 用系统命名法命名应为_______。
用系统命名法命名应为_______。
(5)分别将等物质的量的 C3H8、C4H8 完全燃烧,消耗氧气质量多的是_______(填分子式)。
(6)下列最简式中,只能代表一种有机物的有_______ (选填对应的序号)。
①CH3 ②CH2 ③CH2O ④CH4O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用平衡移动原理解释的是( )
A.新制氯水中加入CaCO3固体可增大HClO分子的浓度
B.钢铁在潮湿的空气中比在干燥空气中更容易生锈
C.通入过量的空气与SO2反应可以提高SO2的利用率
D.由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com