
����Ŀ��![]() ��һ�ֳ�����ǿ����������Ҫ���ڷ�������������ҩ�ȡ�����ij�����̿�
��һ�ֳ�����ǿ����������Ҫ���ڷ�������������ҩ�ȡ�����ij�����̿�![]() ��Ҫ�ɷ�
��Ҫ�ɷ�![]() ������
������![]() ��
��![]() ��
��![]() ��
��![]() ���������ͨ�����¼����̼��ѳ�ȼúβ���е�
���������ͨ�����¼����̼��ѳ�ȼúβ���е�![]() �����Ƶ�
�����Ƶ�![]() ��Ӧ�����Ѿ�ʡ��
��Ӧ�����Ѿ�ʡ��![]() ��
��
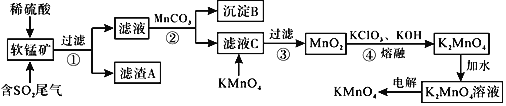
��֪��![]() ��
��![]() �ش��������⣺
�ش��������⣺
![]() ����A�ijɷ���
����A�ijɷ���![]() д��ѧʽ
д��ѧʽ![]() ______��
______��
![]() ��������Bʱ������������������
��������Bʱ������������������![]() д��ѧʽ
д��ѧʽ![]() ______��
______��
![]() ����2���
����2�м���![]() ������Ϊ______��
������Ϊ______��
![]() ��ҺC�м���
��ҺC�м���![]() ʱ������Ӧ�����ӷ���ʽ��______��
ʱ������Ӧ�����ӷ���ʽ��______��
![]() ��ɲ���4�з�Ӧ�Ļ�ѧ����ʽ______
��ɲ���4�з�Ӧ�Ļ�ѧ����ʽ______![]() ______
______![]() ______
______![]() ______
______

![]() ����Ʊ�
����Ʊ�![]() ��װ����ͼ��ʾ�����Һ�����ѡ��______���ӽ���Ĥ
��װ����ͼ��ʾ�����Һ�����ѡ��______���ӽ���Ĥ![]() ����������������
����������������![]() �����ʱ�������ĵ缫��ӦʽΪ______��
�����ʱ�������ĵ缫��ӦʽΪ______��
���𰸡�![]()
![]() ������Һ��pH���ٽ�
������Һ��pH���ٽ�![]() ��
��![]() ˮ���Գ�����ʽ��ȥ
ˮ���Գ�����ʽ��ȥ ![]() 3 6 3
3 6 3 ![]() ��
�� ![]()
��������
�����̿�![]() ��Ҫ�ɷ�
��Ҫ�ɷ�![]() ������
������![]() ��
��![]() ��
��![]() ��
��![]() ͨ�뺬��
ͨ�뺬��![]() ��β����ͬʱ����ϡ���
��β����ͬʱ����ϡ���![]() ��
��![]() ��
��![]() ��
��![]() ���ܣ����ˣ�����AΪ
���ܣ����ˣ�����AΪ![]() ����Һ�к��еĽ�������Ϊ��
����Һ�к��еĽ�������Ϊ��![]() ��
��![]() ��
��![]() ������
������![]() ������Һ��pH���ٽ�
������Һ��pH���ٽ�![]() ��
��![]() ˮ���Գ�����ʽ��ȥ������BΪ
ˮ���Գ�����ʽ��ȥ������BΪ![]() ��
��![]() ����ҺC����Ҫ����
����ҺC����Ҫ����![]() ������
������![]() ʱ������̬���з�Ӧ��
ʱ������̬���з�Ӧ��![]() �����˵õ�
�����˵õ�![]() ����
����![]() ��KOH���ڷ�Ӧ��
��KOH���ڷ�Ӧ��![]() ���õ�
���õ�![]() ����ˮ��Һ�õ���Һ�����
����ˮ��Һ�õ���Һ�����![]() ��Һ�õ���Ʒ
��Һ�õ���Ʒ![]() ���ݴ˷�������
���ݴ˷�������
![]() ���̿���
���̿���![]() �������ᣬ���ˣ�����AΪ
�������ᣬ���ˣ�����AΪ![]() ��
��
�ʴ�Ϊ��![]() ��
��
![]() ����������֪����BΪ
����������֪����BΪ![]() ��
��![]() ����֪��
����֪��![]() ��
��![]() ��
��![]() ���ܽ�ȸ�С���ȳ�����
���ܽ�ȸ�С���ȳ�����
�ʴ�Ϊ��![]() ��
��
![]() ����2���
����2�м���![]() ������Ϊ������Һ��pH���ٽ�
������Ϊ������Һ��pH���ٽ�![]() ��
��![]() ˮ���Գ�����ʽ��ȥ��
ˮ���Գ�����ʽ��ȥ��
�ʴ�Ϊ��������Һ��pH���ٽ�![]() ��
��![]() ˮ���Գ�����ʽ��ȥ��
ˮ���Գ�����ʽ��ȥ��
![]() ��ҺC��Ҫ����
��ҺC��Ҫ����![]() ������
������![]() ʱ������̬���з�Ӧ��
ʱ������̬���з�Ӧ��![]() ��
��
�ʴ�Ϊ��![]() ��
��
![]() ͨ�����̿�֪����4�з�ӦΪ
ͨ�����̿�֪����4�з�ӦΪ![]() ��
��![]() ��KOH��������
��KOH��������![]() �ķ�Ӧ������ʽΪ��
�ķ�Ӧ������ʽΪ��![]() ��
��
�ʴ�Ϊ��3��6��3��![]() ��
��
![]() ����Ϊ
����Ϊ![]() ��Һ������ʧȥ���ӷ���������Ӧ��Ϊ
��Һ������ʧȥ���ӷ���������Ӧ��Ϊ![]() ��˵��
��˵��![]() ���������ɣ���ӦΪ�����ӽ���Ĥ��
���������ɣ���ӦΪ�����ӽ���Ĥ��
�ʴ�Ϊ������![]() ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������I(C12H14O3)���Ʊ�Һ�����ϵ��м���֮һ��������к���ȩ����������I������E��H��һ�������ºϳ�:
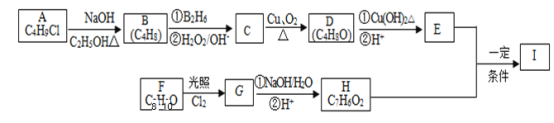
��֪������Ϣ��
��A�ĺ˴Ź������ױ�����ֻ��һ�ֻ�ѧ�������⣻
��R-CH=CH2 ![]() R-CH2-CH2-OH��
R-CH2-CH2-OH��
��������F�����ϵ�һ�ȴ���ֻ����������Fe3+����ɫ��
��ͨ����ͬһ��̼ԭ�������������ǻ����ȶ�������ˮ�γ��ʻ���
��ش��������⣺
(1)A�Ľṹ��ʽΪ_____��C������Ϊ________��
(2)B���������ŵ�������_______��E�ķ���ʽΪ________��
(3)A��B��C��D�ķ�Ӧ���ͷֱ�Ϊ________��________��
(4)д��F��G�Ļ�ѧ����ʽ��___________��
(5)I�Ľṹ��ʽΪ___________��
(6)I��ͬϵ��J��I��Է�������С28��J��ͬ���칹������ͬʱ����������������������ֻ��һ��ȡ�����������ܷ���������Ӧ�������뱥��NaHCO3��Һ��Ӧ�ų�CO2������____��(�����������칹)������ͬ���칹������һ�ַ���������Ӧ���ữ��˴Ź�������Ϊ����壬�ҷ������Ϊ1��2��2��2��3��д��J������ͬ���칹��Ľṹ��ʽ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
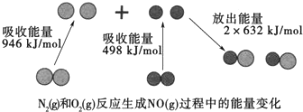
����Ŀ������β���к���CO��NO���к����塣
��1������β����NO���ɹ��̵������仯��ͼʾ��1molN2��1molO2��ȫ��Ӧ����NO��____�����������������ų�����____kJ������
��2��ͨ��NO�������ɼ������β����NO�ĺ������乤��ԭ����ͼ��ʾ������ʾ��O2-���ڴ˹��������������ƶ���
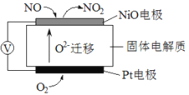
��NiO�缫�Ϸ�������___________��Ӧ������������������ԭ������
�����·�У������Ǵ�_________�缫����������NiO������Pt������
��Pt�缫�ϵĵ缫��ӦʽΪ________________________��
��3��һ�����ʹ�������NO��CO�ķ�Ӧ��2NO+2CO![]() 2CO2+N2����֪��������ıȱ��������߸÷�Ӧ���ʣ�Ϊ����֤�¶ȡ������ıȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ijͬѧ���������ʵ�飬���������Ѿ������±��С�
2CO2+N2����֪��������ıȱ��������߸÷�Ӧ���ʣ�Ϊ����֤�¶ȡ������ıȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ijͬѧ���������ʵ�飬���������Ѿ������±��С�
ʵ���� | t���棩 | NO��ʼŨ�� ��mol/L�� | CO��ʼŨ�ȣ�mol/L�� | �����ıȱ������m2/g�� |
�� | 280 | 1.2��10��3 | 5.80��10��3 | 82 |
�� | 280 | 1.2��10��3 | b | 124 |
�� | 350 | a | 5.80��10��3 | 82 |
���뽫�������ݲ���������a ___________��
������֤�¶ȶԻ�ѧ��Ӧ���ʹ��ɵ���ʵ��____________����ʵ����ţ���
��ʵ����ʵ����У�NO�����ʵ���Ũ��c��NO����ʱ��t�ı仯������ͼ��ʾ�����б�ʾʵ����������_______����������������������
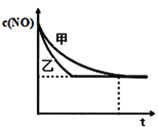
��4�����ݻ��̶��ľ��������з�����Ӧ2NO+2CO![]() 2CO2+N2������˵���Ѵﵽƽ��״̬����________��������ѡ��
2CO2+N2������˵���Ѵﵽƽ��״̬����________��������ѡ��
A�������ڻ�������¶Ȳ��ٱ仯 B�������ڵ�����ѹǿ���ֲ���
C��2����(NO)=����(N2) D�������ڻ�������ܶȱ��ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1Lij��ҺA�д���![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() �е��������ӣ�Ũ�Ⱦ�Ϊ
�е��������ӣ�Ũ�Ⱦ�Ϊ![]() ��A��Һ��������ʵ�飬����������ͼ��ʾ
��A��Һ��������ʵ�飬����������ͼ��ʾ![]() ���ֲ���ʡ��
���ֲ���ʡ��![]() ����Ӧ
����Ӧ![]() �����ҺB����ҺA�е�������������ͬ�����н�����ȷ����
�����ҺB����ҺA�е�������������ͬ�����н�����ȷ����![]()
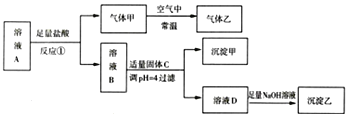
A.��ҺB�д��ڵ���������![]() ��
��![]() ��
��![]()
B.����C������MgO��![]() ��
��![]()
C.��������![]() ����������
����������![]()
D.A�в���ȷ����������![]() ��
��![]() ��
��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������½�40g��ĥ�ɷ�ĩ��![]() ��
��![]() ����250mL��ƿ�У�Ѹ�ٽ���ʹ����ҩƷ��Ͼ��ȣ����ڲ����ܿ�����һ��ʪ��ĺ�ɫʯ����ֽ����ͼ��ʾ������ش��������⣺
����250mL��ƿ�У�Ѹ�ٽ���ʹ����ҩƷ��Ͼ��ȣ����ڲ����ܿ�����һ��ʪ��ĺ�ɫʯ����ֽ����ͼ��ʾ������ش��������⣺
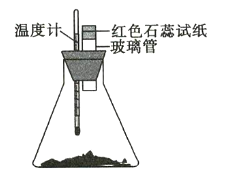
��1��ʪ��ĺ�ɫʯ����ֽ�����ı仯��_________________����ԭ����_______��
��2���¶ȼƵı仯��_______________________����ԭ����_______________________ ��
��3����ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ__________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ��������������ٴ��ع��������ٿ����������˿���Ͻ�ֺ�ѧ�������С�����ʹ�ߡ��������������ٿ���Ҫ�ɷ�ΪCaWO4�������ж������衢�����������ʣ�Ϊԭ��ұ���ߴ��Ƚ����٣���ҵ������ͼ��
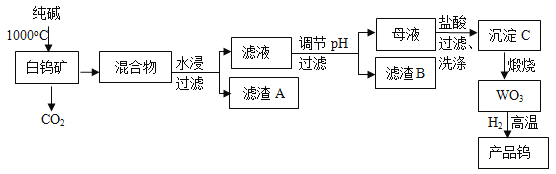
��֪�����������Ժ�����������ˮ��
����ȫ�������ӵ�pHֵ��SiO32��Ϊ8��WO42��Ϊ5��
��̼�ͽ������ڸ����»ᷴӦ����̼���١�
�ش��������⣺
��1����ҵ������������Ƶ�̼�����ƣ��˷��С��������Ϊ�ҹ�����ר�Һ�°���������ʳ��ˮ����ͨ��NH3����ͨ��CO2����������̼�����ƾ�����Ȼ����Һ��д���û�ѧ��Ӧ����ʽ��____��
��2�������а��ٿ�CaWO4�ʹ�����Ļ�ѧ��Ӧ����ʽ�ǣ�____��
��3������B����Ҫ�ɷ��ǣ�д��ѧʽ��___������pH��ѡ�õ��Լ��ǣ�__����ѡ���
A����ˮ B������ C��NaOH��Һ D��Na2CO3��Һ
��4���������C�Ѿ�ϴ�Ӹɾ��IJ�����____��
��5��Ϊ�˻�ÿ������Ƶ�˿�ĸߴ��Ƚ����٣�������̼����������������ԭ����ԭ���ǣ�___��
��6�����������Ƽ��������Ƽ�����Һ�пɵõ�����ƣ���֪ij�¶�ʱ��Ksp(CaWO4)��1��10��10��Ksp[Ca(OH)2]��4��10��7������Һ��WO42��ǡ�ó�����ȫ������Ũ�ȵ���10��5mol/L��ʱ����Һ��c(OH��)��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£����Ϊ2L���ܱ������У�1molX��3mol Y���з�Ӧ��X(g)��3Y(g)![]() 2Z(g)����12s�ﵽƽ�⣬����0.6molZ������˵����ȷ���ǣ� ��
2Z(g)����12s�ﵽƽ�⣬����0.6molZ������˵����ȷ���ǣ� ��
A.��XŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.125mol/(L��s)
B.12s�������������Ϊ10L��Z��ƽ��Ũ�ȱ�Ϊԭ����![]()
C.������X��Ũ�ȣ�������Y��ת���ʼ�С
D.���÷�Ӧ����H<0�������¶ȣ�ƽ�ⳣ��K��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��﮵��ص����������Ǿ�2-��ϩ���(��дΪP2VP)��I2�ĸ��������������ڱ�Ĥ״�ĵ⻯ﮣ��õ�ط������ܷ�ӦΪ2Li+P2VP��nI2![]() P2VP��(n-1)I2+2LiI������˵����ȷ���� ( )
P2VP��(n-1)I2+2LiI������˵����ȷ���� ( )
A.�õ�طŵ�ʱ��﮵缫������ԭ��Ӧ
B.�õ�طŵ�ʱ����������������
C.P2VP��I2�ĸ������Ǿ�Ե�壬���ܵ��磬���ʱ�����Դ�ĸ�������
D.�ŵ�ʱ�����ĵ缫��ӦʽΪP2VP��nI2+2e-+2Li+=P2VP��(n-1)I2+2LiI
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�����ͼ��ʾʵ�飬̽����Ӧ�е������仯�������ж���ȷ����(�� ��)

A.��ʵ���֪��(a)��(b)��(c)���漰�ķ�Ӧ���Ƿ��ȷ�Ӧ
B.��ʵ��(a)�е���Ƭ����Ϊ�����������ۺ��ͷų���������������
C.ʵ��(c)�н����β����������Ϊ���ʽ������ʵ����û��Ӱ��
D.����NaOH����ⶨ�к��ȣ���ⶨ��ֵƫ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com