
����Ŀ��﮵��ص����������Ǿ�2-��ϩ���(��дΪP2VP)��I2�ĸ��������������ڱ�Ĥ״�ĵ⻯ﮣ��õ�ط������ܷ�ӦΪ2Li+P2VP��nI2![]() P2VP��(n-1)I2+2LiI������˵����ȷ���� ( )
P2VP��(n-1)I2+2LiI������˵����ȷ���� ( )
A.�õ�طŵ�ʱ��﮵缫������ԭ��Ӧ
B.�õ�طŵ�ʱ����������������
C.P2VP��I2�ĸ������Ǿ�Ե�壬���ܵ��磬���ʱ�����Դ�ĸ�������
D.�ŵ�ʱ�����ĵ缫��ӦʽΪP2VP��nI2+2e-+2Li+=P2VP��(n-1)I2+2LiI
���𰸡�D
��������
A.�õ�طŵ�ʱ��������ӦʽΪ2Li-2e-=2Li+��﮵缫����������Ӧ��Li��������A����
B.ԭ����е�������������ɽ϶�ĸ���Li��B����
C.���������Ǿ�2-��ϩ���(��дΪP2VP)��I2�ĸ�����缫�������Ǿ�Ե�壬C����
D.﮵��ص������ĵ缫��ӦʽΪP2VPnI2+2Li++2e-=P2VP(n-1)I2+2LiI��������ӦʽΪ2Li-2e-=2Li+���ܷ�ӦΪ2Li+P2VPnI2=P2VP(n-1)I2+2LiI��D��ȷ��
�ʺ���ѡ����D��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��M�������㾫�͵���Ҫ�ɷ֣��ṹ��ʽ��![]() ������A����DΪԭ�Ϻϳ�M����������
������A����DΪԭ�Ϻϳ�M����������![]() ���ַ�Ӧ����δע��
���ַ�Ӧ����δע��![]() ��
��
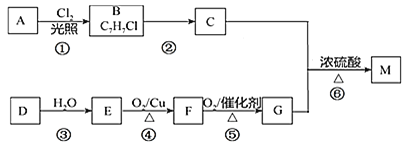
��д��D�ĵ���ʽ______��
���ڢ���ת��������ȡ����Ӧ����______�ӳɷ�Ӧ����______��
��д���ڡ��ܵķ�Ӧ����ʽ______��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ��һ�ֳ�����ǿ����������Ҫ���ڷ�������������ҩ�ȡ�����ij�����̿�
��һ�ֳ�����ǿ����������Ҫ���ڷ�������������ҩ�ȡ�����ij�����̿�![]() ��Ҫ�ɷ�
��Ҫ�ɷ�![]() ������
������![]() ��
��![]() ��
��![]() ��
��![]() ���������ͨ�����¼����̼��ѳ�ȼúβ���е�
���������ͨ�����¼����̼��ѳ�ȼúβ���е�![]() �����Ƶ�
�����Ƶ�![]() ��Ӧ�����Ѿ�ʡ��
��Ӧ�����Ѿ�ʡ��![]() ��
��
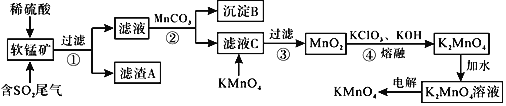
��֪��![]() ��
��![]() �ش��������⣺
�ش��������⣺
![]() ����A�ijɷ���
����A�ijɷ���![]() д��ѧʽ
д��ѧʽ![]() ______��
______��
![]() ��������Bʱ������������������
��������Bʱ������������������![]() д��ѧʽ
д��ѧʽ![]() ______��
______��
![]() ����2���
����2�м���![]() ������Ϊ______��
������Ϊ______��
![]() ��ҺC�м���
��ҺC�м���![]() ʱ������Ӧ�����ӷ���ʽ��______��
ʱ������Ӧ�����ӷ���ʽ��______��
![]() ��ɲ���4�з�Ӧ�Ļ�ѧ����ʽ______
��ɲ���4�з�Ӧ�Ļ�ѧ����ʽ______![]() ______
______![]() ______
______![]() ______
______

![]() ����Ʊ�
����Ʊ�![]() ��װ����ͼ��ʾ�����Һ�����ѡ��______���ӽ���Ĥ
��װ����ͼ��ʾ�����Һ�����ѡ��______���ӽ���Ĥ![]() ����������������
����������������![]() �����ʱ�������ĵ缫��ӦʽΪ______��
�����ʱ�������ĵ缫��ӦʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���밴Ҫ��ش��������⣺
(1)��Ȳ�ĵ���ʽ_______��
(2)ij��̬�л���������������ܶ�Ϊ 14������ṹ��ʽΪ_______��
(3)ij�л���Ľṹ��ʽ��ͼ��ʾ������һ�ȴ��ﹲ��_______�֡�
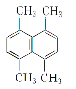
(4)�л���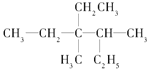 ��ϵͳ����������ӦΪ_______��
��ϵͳ����������ӦΪ_______��
(5)�ֱ����ʵ����� C3H8��C4H8 ��ȫȼ�գ������������������_______(�����ʽ)��
(6)�������ʽ�У�ֻ�ܴ���һ���л������_______ (ѡ���Ӧ�����)��
��CH3 ��CH2 ��CH2O ��CH4O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������C��H��O���л���3.24 g��װ��Ԫ�ط���װ�ã�ͨ��������O2ʹ����ȫȼ�գ������ɵ���������ͨ���Ȼ��Ƹ����A�ͼ�ʯ�Ҹ����B�����A������������2.16g��B��������9.24g����֪���л������Է�������Ϊ108��
��1��ȼ�մ˻�����3.24g�������������������Ƕ���______��
��2����˻�����ķ���ʽ______����Ҫ�м�����̣�
��3���û�����1�����д���1��������1���ǻ�����д������ͬ���칹��Ľṹ��ʽ______��������Ҫ������˵�����̣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��������ͼ��ʾװ����ȡ�������ṩ���Լ���Ũ���ᡢ����NaCl��Һ��NaOH��Һ��������ع��塣��Ӧ�Ļ�ѧ����ʽΪ![]() ��
��
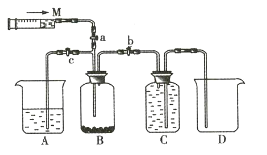
��1��Ũ�����ڴ˷�Ӧ����ʾ������������_______________________������ţ���
A.��ԭ�� B.��ԭ�Ժ�����
C.������ D.�����Ժ�����
��2��װ��C��ʢ�ŵ��Լ���_______________________��
��3��β������ʱ��رյ��ɼ�a�͵��ɼ�___________________�����ɼ�_____________________��
��4�����ú�1.6mol HCl��Ũ�����������ĸ�����ط�Ӧ���ڱ�״�����ռ������������_______________________������ţ���
A. =11.2L B. >11.2L
C. <11.2L D.��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������۲�ͼ��Ȼ��ش����⣺
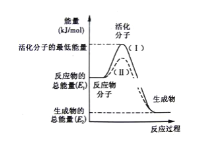
��1��ͼ����ʾ��Ӧ��___(��������������������)��Ӧ
��2��ͼ����ʾ��Ӧ����H=___(�ú�E1��E2�Ĵ���ʽ��ʾ)��
��3������4����Ӧ�У�����ʾ��ͼ�����ķ�Ӧ����____(�����)��
A��������NaOH��Ӧ B��Na��H2O��Ӧ����H2
C�����ȷ�Ӧ D�����ȵ�̿��ˮ������Ӧ����CO��H2
��4���Լ���Ϊԭ����ȡ�����ǹ�ҵ�ϳ��õ����ⷽ������֪��
CH4(g)��H2O(g)=CO(g)��3H2(g) ��H��+206.2kJ/mol
CH4(g)��CO2(g)=2CO(g)��2H2(g) ��H��+247.4kJ/mol
CH4(g)��H2O(g)��Ӧ����CO2(g)��H2(g)���Ȼ�ѧ����ʽΪ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в�����ƽ���ƶ�ԭ�����͵���(�� ��)
A.������ˮ�м���CaCO3���������HClO���ӵ�Ũ��
B.�����ڳ�ʪ�Ŀ����б��ڸ�������и���������
C.ͨ������Ŀ�����SO2��Ӧ�������SO2��������
D.��NO2��N2O4��ɵ�ƽ����ϵ��ѹ����ɫ�ȱ�����dz
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����жԷ�Ӧ�ȵ������У���ȷ���ǣ� ��
A. �����ȼ������H =��890.3 kJ��mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4(g)+2O2(g)=CO2(g)+2H2O(g) ��H =��890.3 kJ��mol-1
B. һ�������£���0.5molN2��1.5molH2�����ܱ������г�ַ�Ӧ����NH3����akJ�����Ȼ�ѧ����ʽΪ��N2(g)+3H2(g)![]() 2NH3(g) ��H =��2a kJ��mol-1
2NH3(g) ��H =��2a kJ��mol-1
C. ��101kPaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8kJ��������ˮ�ֽ���Ȼ�ѧ����ʽ��ʾΪ��2H2O(l) =2H2(g)+O2(g) ��H =+571.6 kJ��mol-1
D. HCl��NaOH��Ӧ�к�����H =��57.3 kJ��mol-1����CH3COOH��NaOH��Ӧ����1molˮʱ�ų�������Ϊ57.3kJ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com