
����Ŀ��������۲�ͼ��Ȼ��ش����⣺
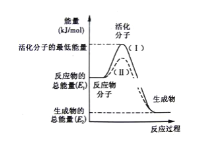
��1��ͼ����ʾ��Ӧ��___(��������������������)��Ӧ
��2��ͼ����ʾ��Ӧ����H=___(�ú�E1��E2�Ĵ���ʽ��ʾ)��
��3������4����Ӧ�У�����ʾ��ͼ�����ķ�Ӧ����____(�����)��
A��������NaOH��Ӧ B��Na��H2O��Ӧ����H2
C�����ȷ�Ӧ D�����ȵ�̿��ˮ������Ӧ����CO��H2
��4���Լ���Ϊԭ����ȡ�����ǹ�ҵ�ϳ��õ����ⷽ������֪��
CH4(g)��H2O(g)=CO(g)��3H2(g) ��H��+206.2kJ/mol
CH4(g)��CO2(g)=2CO(g)��2H2(g) ��H��+247.4kJ/mol
CH4(g)��H2O(g)��Ӧ����CO2(g)��H2(g)���Ȼ�ѧ����ʽΪ��___��
���𰸡����� ��E2 - E1��kJ/mol ABC CH4(g) +2H2O(g)=CO2(g)+4H2(g) ��H=+165.0kJ/mol
��������
����ͼ�������Ӧ��������������������ϵ�������ʱ������������������ȥ��Ӧ�����������ٸ��ݳ����ķ��ȷ�Ӧ���ɷ�����Щ��Ӧ���ڷ��ȷ�Ӧ�����ø�˹������Ŀ�귴Ӧ����ʽ���Ȼ�ѧ����ʽ��
��ͼ����Ϣ��֪��Ӧ�����������������������������Ϊ���ȷ�Ӧ���ʴ�Ϊ�����ȣ�
���ʱ������������������ȥ��Ӧ�������������ͼ����ʾ��Ӧ����H=��E2 - E1��kJ/mol���ʴ�Ϊ����E2 - E1��kJ/mol��
��Aѡ�������NaOH��Ӧ�Ƿ��ȷ�Ӧ���������⣬
Bѡ�Na��H2O��Ӧ����H2�Ƿ��ȷ�Ӧ���������⣬
Cѡ����ȷ�Ӧ�Ƿ��ȷ�Ӧ���������⣬
Dѡ����ȵ�̿��ˮ������Ӧ����CO��H2�����ȷ�Ӧ�����������⣬��ABC��ȷ��
������������ΪABC��
��CH4(g)��H2O(g)=CO(g)��3H2(g) ��H��+206.2kJ/mol
CH4(g)��CO2(g)=2CO(g)��2H2(g) ��H��+247.4kJ/mol
����һ������ʽ����2��ȥ�ڶ�������ʽ���ó�CH4(g)��H2O(g)��Ӧ����CO2(g)��H2(g)���Ȼ�ѧ����ʽΪ��CH4(g) +2H2O(g)=CO2(g)+4H2(g) ��H=+165.0kJ/mol���ʴ�ΪCH4(g) +2H2O(g)=CO2(g)+4H2(g) ��H=+165.0kJ/mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���к���CO��NO���к����塣
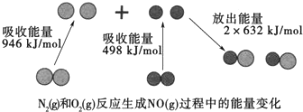
��1������β����NO���ɹ��̵������仯��ͼʾ��1molN2��1molO2��ȫ��Ӧ����NO��____�����������������ų�����____kJ������
��2��ͨ��NO�������ɼ������β����NO�ĺ������乤��ԭ����ͼ��ʾ������ʾ��O2-���ڴ˹��������������ƶ���
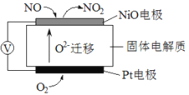
��NiO�缫�Ϸ�������___________��Ӧ������������������ԭ������
�����·�У������Ǵ�_________�缫����������NiO������Pt������
��Pt�缫�ϵĵ缫��ӦʽΪ________________________��
��3��һ�����ʹ�������NO��CO�ķ�Ӧ��2NO+2CO![]() 2CO2+N2����֪��������ıȱ��������߸÷�Ӧ���ʣ�Ϊ����֤�¶ȡ������ıȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ijͬѧ���������ʵ�飬���������Ѿ������±��С�
2CO2+N2����֪��������ıȱ��������߸÷�Ӧ���ʣ�Ϊ����֤�¶ȡ������ıȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ijͬѧ���������ʵ�飬���������Ѿ������±��С�
ʵ���� | t���棩 | NO��ʼŨ�� ��mol/L�� | CO��ʼŨ�ȣ�mol/L�� | �����ıȱ������m2/g�� |
�� | 280 | 1.2��10��3 | 5.80��10��3 | 82 |
�� | 280 | 1.2��10��3 | b | 124 |
�� | 350 | a | 5.80��10��3 | 82 |
���뽫�������ݲ���������a ___________��
������֤�¶ȶԻ�ѧ��Ӧ���ʹ��ɵ���ʵ��____________����ʵ����ţ���
��ʵ����ʵ����У�NO�����ʵ���Ũ��c��NO����ʱ��t�ı仯������ͼ��ʾ�����б�ʾʵ����������_______����������������������
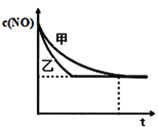
��4�����ݻ��̶��ľ��������з�����Ӧ2NO+2CO![]() 2CO2+N2������˵���Ѵﵽƽ��״̬����________��������ѡ��
2CO2+N2������˵���Ѵﵽƽ��״̬����________��������ѡ��
A�������ڻ�������¶Ȳ��ٱ仯 B�������ڵ�����ѹǿ���ֲ���
C��2����(NO)=����(N2) D�������ڻ�������ܶȱ��ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£����Ϊ2L���ܱ������У�1molX��3mol Y���з�Ӧ��X(g)��3Y(g)![]() 2Z(g)����12s�ﵽƽ�⣬����0.6molZ������˵����ȷ���ǣ� ��
2Z(g)����12s�ﵽƽ�⣬����0.6molZ������˵����ȷ���ǣ� ��
A.��XŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.125mol/(L��s)
B.12s�������������Ϊ10L��Z��ƽ��Ũ�ȱ�Ϊԭ����![]()
C.������X��Ũ�ȣ�������Y��ת���ʼ�С
D.���÷�Ӧ����H<0�������¶ȣ�ƽ�ⳣ��K��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��﮵��ص����������Ǿ�2-��ϩ���(��дΪP2VP)��I2�ĸ��������������ڱ�Ĥ״�ĵ⻯ﮣ��õ�ط������ܷ�ӦΪ2Li+P2VP��nI2![]() P2VP��(n-1)I2+2LiI������˵����ȷ���� ( )
P2VP��(n-1)I2+2LiI������˵����ȷ���� ( )
A.�õ�طŵ�ʱ��﮵缫������ԭ��Ӧ
B.�õ�طŵ�ʱ����������������
C.P2VP��I2�ĸ������Ǿ�Ե�壬���ܵ��磬���ʱ�����Դ�ĸ�������
D.�ŵ�ʱ�����ĵ缫��ӦʽΪP2VP��nI2+2e-+2Li+=P2VP��(n-1)I2+2LiI
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�Խ̲���ͭ��Ũ�����ʵ���������¸Ľ���ʵ��װ����ͼ��ʾ(���Ⱥͼг�װ������ȥ)��
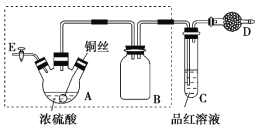
ʵ�鲽�裺
����װ���������װ�������ԣ�
�ڼ����Լ����ر�����E������A���۲�C����Һ��ɫ�仯��
�۽�ͭ˿�����뿪Һ�棬ֹͣ���ȡ�
��1��������߿���װ�������Եķ�����____________________________��
��2��װ��A��������________��װ��B��������_________��װ��D����ʢҩƷ��__________��
��3��װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ____________________________��
��4��ʵ����װ��ǰ��Ϊ�����к������й©��Ӧ����ȡ�IJ�����__________��
��5��ʵ���װ��A���а�ɫ�����������װ��A�й�Һ����ﻺ��ת����ʢ������ˮ���ձ��У��ɹ۲쵽��������______________������ֱ����װ��A�м�ˮ��ԭ����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ҹ��Ĵ�ͳ��Ʒ����Ҷ�к��еIJ��ӿ������ʳƷ���Ӽ��ж������к��ĺϳɿ������������ڶ���ʳƷ���ʵȣ���ͼ��ʾ�Dz����к�����ߵ�һ�ֶ�����A�Ľṹ��ʽ���������ֶ�����A���й�������ȷ����( )
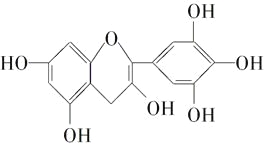
�ٷ���ʽΪC15H12O7
��1 mol������A��һ���������������7 molH2�ӳ�
�۵������Ķ�����A�ֱ��������Ľ����ƺ��������Ʒ�Ӧ�����Ľ����ƺ��������Ƶ����ʵ���֮��Ϊ1��1
��1 mol������A��������Ũ��ˮ��Ӧ���������4 mol Br2
A.�٢�B.�٢�C.�ڢ�D.�ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧר��ͨ��ʵ�鷢�������ֻ��������ڴ��Ե���Ӧ��λ����������������������͵ĵ������ᴦ���ƺ����ȿ��ֵ�״̬�������Ѿ��������������������ֵ��Ե�ͼ���Ƴ���������Ϊ���ڸ�����֮�䴫����Ϣ�Ļ�ѧ�����Ƕ�Ͱ��������������������ֳ�Ϊ��Ͱ�ϵͳ����Ͱ��ṹ��ͼ��
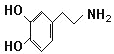
��1����Ͱ�����ʽ��_____��
��2�����ж϶�Ͱ��ܷ����Ļ�ѧ��Ӧ_____��
A.�ӳ� B.ȡ�� C.���� D.ˮ��
��3��д�����з����������������Ͱ���Ϊͬ���칹������ʵĽṹ��ʽ____��
������1��3��5��ȡ����
�ڱ�����ֱ������һ���ǻ���һ������
�۷ֱ������ƺ��������Ʒ�Ӧ�����������������Ƶ����ʵ���֮��Ϊ2��1
��4����Ͱ��������������������鷢��ϵ�з�Ӧ���á��ϳɹ��̱�ʾ��ͼ��
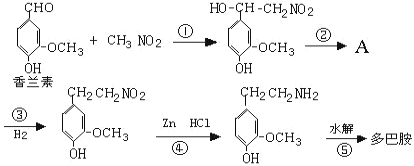
��.д�����з�Ӧ���ͣ���Ӧ��___����Ӧ��___��
��.д���ڵĻ�ѧ����ʽ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�����ͼ��ʾʵ�飬̽����Ӧ�е������仯�������ж���ȷ����(�� ��)

A.��ʵ���֪��(a)��(b)��(c)���漰�ķ�Ӧ���Ƿ��ȷ�Ӧ
B.��ʵ��(a)�е���Ƭ����Ϊ�����������ۺ��ͷų���������������
C.ʵ��(c)�н����β����������Ϊ���ʽ������ʵ����û��Ӱ��
D.����NaOH����ⶨ�к��ȣ���ⶨ��ֵƫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������H�Ǻϳ�������Ѫ�ܼ���ҩ����м��壬��ͨ����ͼ��ʾ;���ϳɣ�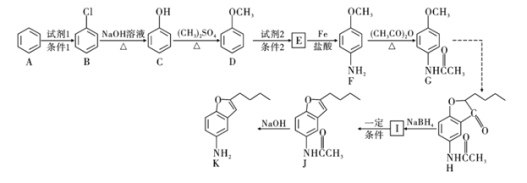
��֪��![]()
![]() ��
��![]() �����ױ�����
�����ױ�����![]() ��
��
![]()
![]() ��
��
�ش��������⣺
��1��д��������D������Ϊ______________��F�еķǺ�������������Ϊ______________
��2��д��![]() �ķ�Ӧ���ͣ�______________��������G�ķ���ʽΪ______________��
�ķ�Ӧ���ͣ�______________��������G�ķ���ʽΪ______________��
��3��д��![]() ��Ӧ�Ļ�ѧ����ʽ��__________________________________________��
��Ӧ�Ļ�ѧ����ʽ��__________________________________________��
��4��������L��Eͬ���칹�壬д��ͬʱ������������L������һ�ֽṹ��ʽ��____________________________��
������![]() ��Һ��Ӧ����ɫ
��Һ��Ӧ����ɫ
�ڱ�����������ȡ����������һ��Ϊ![]()
�۱����ϵ�һ��ȡ��������ͬ���칹��
��5���ϳ�;���У�Fת��ΪG��Ŀ����___________________________________��
��6�����������ϳ�·�ߣ��Ա���![]() Ϊԭ��
Ϊԭ��![]() ���Լ���ѡ
���Լ���ѡ![]() ������Ʊ�
������Ʊ�![]() �ĺϳ�·�ߡ�________________
�ĺϳ�·�ߡ�________________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com