
����Ŀ������β���к���CO��NO���к����塣
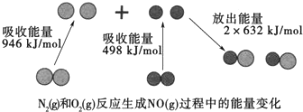
��1������β����NO���ɹ��̵������仯��ͼʾ��1molN2��1molO2��ȫ��Ӧ����NO��____�����������������ų�����____kJ������
��2��ͨ��NO�������ɼ������β����NO�ĺ������乤��ԭ����ͼ��ʾ������ʾ��O2-���ڴ˹��������������ƶ���
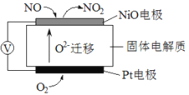
��NiO�缫�Ϸ�������___________��Ӧ������������������ԭ������
�����·�У������Ǵ�_________�缫����������NiO������Pt������
��Pt�缫�ϵĵ缫��ӦʽΪ________________________��
��3��һ�����ʹ�������NO��CO�ķ�Ӧ��2NO+2CO![]() 2CO2+N2����֪��������ıȱ��������߸÷�Ӧ���ʣ�Ϊ����֤�¶ȡ������ıȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ijͬѧ���������ʵ�飬���������Ѿ������±��С�
2CO2+N2����֪��������ıȱ��������߸÷�Ӧ���ʣ�Ϊ����֤�¶ȡ������ıȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ijͬѧ���������ʵ�飬���������Ѿ������±��С�
ʵ���� | t���棩 | NO��ʼŨ�� ��mol/L�� | CO��ʼŨ�ȣ�mol/L�� | �����ıȱ������m2/g�� |
�� | 280 | 1.2��10��3 | 5.80��10��3 | 82 |
�� | 280 | 1.2��10��3 | b | 124 |
�� | 350 | a | 5.80��10��3 | 82 |
���뽫�������ݲ���������a ___________��
������֤�¶ȶԻ�ѧ��Ӧ���ʹ��ɵ���ʵ��____________����ʵ����ţ���
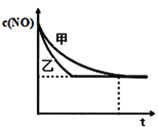
��ʵ����ʵ����У�NO�����ʵ���Ũ��c��NO����ʱ��t�ı仯������ͼ��ʾ�����б�ʾʵ����������_______����������������������
��4�����ݻ��̶��ľ��������з�����Ӧ2NO+2CO![]() 2CO2+N2������˵���Ѵﵽƽ��״̬����________��������ѡ��
2CO2+N2������˵���Ѵﵽƽ��״̬����________��������ѡ��
A�������ڻ�������¶Ȳ��ٱ仯 B�������ڵ�����ѹǿ���ֲ���
C��2����(NO)=����(N2) D�������ڻ�������ܶȱ��ֲ���
���𰸡����� 180 ���� NiO O2+4e��=2O2�� 1.2��10��3 ������ �� CD
��������
��1����ͼ��֪��1molN2��1molO2��ȫ��Ӧ����NOʱ�����յ����������ڷų������������÷�ӦΪ���ȷ�Ӧ��
��2��ԭ��ع���ʱ���������������ƶ������������ƶ��������ӵĶ����ƶ���֪NiO��Ϊԭ��صĸ�����Pt��Ϊԭ��ص�����������������ԭ��Ӧ����������������Ӧ��
��3���������֪����ʵ��Ŀ��֤�¶ȡ������ȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ʵ��ʱӦע������������ͬ������£������жϱ��������ʵ�Ӱ�죬Ҫ��֤�¶ȶ����ʵ�Ӱ�죬�����ıȱ��������Ӧ��ij�ʼŨ�ȵ�Ҫ��ͬ��ͬ����֤�����ıȱ���������ʵ�Ӱ�죬�¶ȡ���Ӧ��ij�ʼŨ��Ҫ��ͬ��
��4����һ�������£������淴Ӧ������Ӧ���ʺ��淴Ӧ�������ʱ������Ϊ0������Ӧ��ϵ�и������ʵ�Ũ�Ȼ������ٷ����仯��״̬����Ϊ��ѧƽ��״̬��
��1����ͼ��֪��1molN2��1molO2��ȫ��Ӧ����NOʱ����Ӧ�ﻯѧ���ƻ����յ�������Ϊ946kJ +498kJ=1444kJ���������γɻ�ѧ���ų���������Ϊ2��632kJ=1264kJ����Ӧʱ��Ҫ����180kJ���������ʴ�Ϊ�����գ�180��
��2����ԭ����У�NiOΪ�������缫��NOʧ���ӷ���������Ӧ���ɶ����������ʴ�Ϊ��������
�����·�У������ɸ���NiO����������������������Pt�����ʴ�Ϊ��NiO��
��ԭ����У�Pt�缫Ϊ������ O2�������Ϸ�����ԭ��Ӧ����O2-���缫��ӦʽΪO2+4e��=2O2�����ʴ�Ϊ��O2+4e��=2O2����
��3�����ɱ������ݿ�֪��ʵ����¶���ͬ�������ıȱ������ͬ��ʵ��Ŀ������֤�����ıȱ���������ʵ�Ӱ�죬���¶Ⱥͷ�Ӧ��ij�ʼŨ��Ҫ��ͬ��ʵ��I��������ıȱ������ͬ���¶Ȳ�ͬ��ʵ��Ŀ������֤�¶ȶ����ʵ�Ӱ�죬��Ӧ��ij�ʼŨ��Ҫ��ͬ��aӦ��Ϊ1.2��10��3mol/L���ʴ�Ϊ��1.2��10��3��
���ɱ������ݿ�֪��ʵ��I��������ıȱ������ͬ���¶Ȳ�ͬ��ʵ��Ŀ������֤�¶ȶ����ʵ�Ӱ�죬�ʴ�Ϊ����͢�
���������ıȱ������ͬ���¶���ͬ����Ӧ��ij�ʼŨ�ȣ������ıȱ������ƽ���ƶ���Ӱ�죬��������ʴ��ȴﵽ��ѧƽ�⣬��ʵ���ѡ�����ң��ʴ�Ϊ���ң�
��4��A����Ӧ�ھ��������н��У������ڻ�������¶Ȼ�仯�����¶Ȳ��ٱ仯ʱ��˵����Ӧ�Ѵﵽƽ�⣻
B���÷�Ӧ��һ�����������С�ķ�Ӧ���������ڵ�����ѹǿ���ֲ��䣬˵�����淴Ӧ������ȣ���Ӧ�Ѵﵽƽ�⣻
C����Ӧ�Ѵﵽƽ�⣬���淴Ӧ������ȣ�����(NO)= 2����(N2)��2����(NO)=����(N2)˵����Ӧû�дﵽƽ��״̬��
D���������غ㶨�ɿ�֪����Ӧǰ�������������䣬������������䣬�������ڻ�������ܶ�һֱ���ֲ��䣬���������ܶȲ��䲻��˵����Ӧ�Ѵﵽƽ�⣻
����˵����Ӧ�Ѵ�ƽ��״̬��ΪCD���ʴ�Ϊ��CD��


 ������ϵ�д�
������ϵ�д� �±�Сѧ��Ԫ�Բ���ϵ�д�
�±�Сѧ��Ԫ�Բ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̼ѭ������������ĸ߶����ӣ���֪ú������ȿ�����ˮ������Ӧ������CO��H2Ϊ���ĺϳ������ϳ����й㷺Ӧ�ã��Իش��������⣺
(1)��¯������CO�������Ҫ��;֮һ���������ӦΪ��FeO(s)+CO(g)![]() Fe(s)+CO2(g) ��H��0����֪��1100��Cʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=0.263��
Fe(s)+CO2(g) ��H��0����֪��1100��Cʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=0.263��
���¶����ߣ�ƽ���ƶ���ﵽ��ƽ�⣬��ʱƽ�ⳣ��ֵ____(��������������С����������)��
��1100��Cʱ��ø�¯�У�c(CO2)=0.025mol��L��1��c(CO)=0.1mol��L��1��������������£��÷�Ӧ��һʱ����_______����(����������������)��
(2)Ŀǰ��ҵ��Ҳ����CO2������ȼ�ϼ״�CH3OH���йط�ӦΪ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)����H=��49.0KJmol��1��ij�¶��£������Ϊ1L�����ܱ������У�����1molCO2��3molH2����Ӧ�����в��CO2��CH3OH(g)��Ũ����ʱ��ı仯��ͼ��ʾ��
CH3OH(g)+H2O(g)����H=��49.0KJmol��1��ij�¶��£������Ϊ1L�����ܱ������У�����1molCO2��3molH2����Ӧ�����в��CO2��CH3OH(g)��Ũ����ʱ��ı仯��ͼ��ʾ��
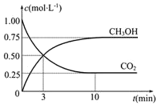
�ٷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)=______��CO2��ת����Ϊ_____�����¶���������Ӧ��ƽ�ⳣ��K=_____(������ʾ)��
�ڷ�Ӧ�ﵽƽ���������ʹ![]() ��ֵ����Ĵ�ʩ��______(�����)��
��ֵ����Ĵ�ʩ��______(�����)��
a�������¶� b���ٳ���H2 c���ٳ���CO2 d����H2O(g)����ϵ�з��� e������He(g)
�����������������Ʒ�Ӧ2CO(g)=2C(s)+O2(g) (��H��0)������CO����Ⱦ�������ж�������Ӧ�Ƿ����Է����в�˵������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������G��һ�ֿ���������������ҩ�ʵ�����ɷ�����A�Ʊ�G�ĺϳ�·�����£�
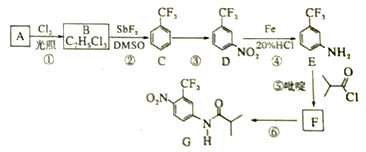
�ش��������⣺
��1��A�Ľṹ��ʽΪ_______________��C�Ļ�ѧ������________________________��
��2�����ķ�Ӧ�Լ��ͷ�Ӧ�����ֱ���______________________���÷�Ӧ��������___________��
��3�����ķ�Ӧ����ʽΪ_____________________________________________��
�����һ���л����������______________________________��
��4��G�ķ���ʽΪ______________________________��
��5��H��G��ͬ���칹�壬�䱽���ϵ�ȡ������G����ͬ��λ�ò�ͬ���������ܵĽṹ��_________�֡�
��6��4-����������������![]() ������Ҫ�ľ�ϸ�����м��壬д���ɱ����ѣ�
������Ҫ�ľ�ϸ�����м��壬д���ɱ����ѣ�![]() ���Ʊ�С���������ᱽ���ĺϳ�·�ߣ������Լ���ѡ��_______________��
���Ʊ�С���������ᱽ���ĺϳ�·�ߣ������Լ���ѡ��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����![]() ��Һ������ˮ�еĻ�ԭ����Ⱦ��M��Ϊ�о��併��Ч����������¶Ա�ʵ��̽���¶ȡ�Ũ�ȡ�pH�Խ������ʺ�Ч����Ӱ�죬ʵ����M��Ũ�ȱ仯��ʱ��Ĺ�ϵ��ͼ��ʾ������˵������ȷ���ǣ� ��
��Һ������ˮ�еĻ�ԭ����Ⱦ��M��Ϊ�о��併��Ч����������¶Ա�ʵ��̽���¶ȡ�Ũ�ȡ�pH�Խ������ʺ�Ч����Ӱ�죬ʵ����M��Ũ�ȱ仯��ʱ��Ĺ�ϵ��ͼ��ʾ������˵������ȷ���ǣ� ��
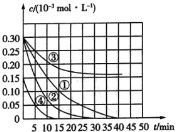
ʵ���� | �¶ȣ�K�� | pH |
�� | 298 | 1 |
�� | 310 | 1 |
�� | 298 | 7 |
�� | 298 | 1 |
A.ʵ�����15min��M�Ľ�������Ϊ![]()
B.������������ͬ��ʵ��٢�˵�������¶ȣ�M������������
C.������������ͬ��ʵ��٢�֤��pHԽ�ߣ�Խ������M�Ľ���
D.������������ͬ��ʵ��٢�˵��M��Ũ��ԽС�����������Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������3���Ȼ�ѧ����ʽ��H2(g)+![]() O2(g)= H2O(g) ��H=a kJ/mol��H2(g)+
O2(g)= H2O(g) ��H=a kJ/mol��H2(g)+ ![]() O2(g)= H2O(l) ��H=b kJ/mol��2H2(g) +
O2(g)= H2O(l) ��H=b kJ/mol��2H2(g) + ![]() O2(g)= 2H2O(l) ��H=c kJ/mol���������ǵ����б�����ȷ���ǣ�
O2(g)= 2H2O(l) ��H=c kJ/mol���������ǵ����б�����ȷ���ǣ�
A.���Ƕ������ȷ�ӦB.a��b��c��Ϊ��ֵC.a=bD.c=2b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���G�Ǻϳ�ij�����Ⱦۺ���ĵ��壬��ϳɷ������£�
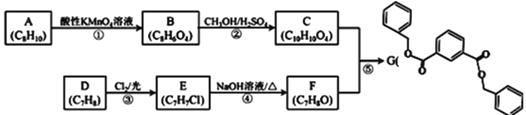
��֪��R1COOR2+R3OH![]() R1COOR3+R2OH
R1COOR3+R2OH
![]() �к��������ŵ������� ______ ��F�������� ______ ��
�к��������ŵ������� ______ ��F�������� ______ ��
![]() ���������е�ȡ����Ӧ��
���������е�ȡ����Ӧ��![]() ��
��![]() ��� ______
��� ______ ![]() �����
�����![]() ��������E�ĺ˴Ź�������ͼ�й��� ______ �����շ壬�������Ϊ ______ ��
��������E�ĺ˴Ź�������ͼ�й��� ______ �����շ壬�������Ϊ ______ ��
![]() �����кϳ�·�߿ɵõ�F��ͬ���칹��H����ɼ���H��F���Լ��� ______ ��
�����кϳ�·�߿ɵõ�F��ͬ���칹��H����ɼ���H��F���Լ��� ______ ��
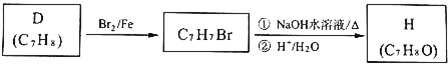
![]() ��NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ ______ ��
��NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ ______ ��
![]() ��ͬ���칹��K�����������ʣ�
��ͬ���칹��K�����������ʣ�![]() ����NaOH��Һ��Ӧ����1molK��ȫ��Ӧ����4molNaOH
����NaOH��Һ��Ӧ����1molK��ȫ��Ӧ����4molNaOH![]() �ܷ���������Ӧ����1molK��������������Һ��Ӧ����4molAg
�ܷ���������Ӧ����1molK��������������Һ��Ӧ����4molAg![]() �����б����ϵ�һ��ȡ����ֻ��һ�֡���K�Ľṹ��ʽΪ ______ ��
�����б����ϵ�һ��ȡ����ֻ��һ�֡���K�Ľṹ��ʽΪ ______ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н�������A��B��C��D������ס��ҡ���������E��F��G��H��I������֮���ܷ������·�Ӧ��ͼ����Щ��Ӧ�IJ���ͷ�Ӧ������û��ȫ���������

�����������Ϣ�ش��������⣺
��1��д���������ʵĻ�ѧʽ�� B____________�� F_____________��
��2����֪A��һ���������������DZͧ�Ĺ����������������﹩��ʱ�Ļ�ѧ����ʽΪ_____________
��3�����������ӷ���ʽ��________________��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������м����л��A��CH4 B��(CH3)2C=CH��CH3 C��C2H2 D��C6H14 E��CH2=CH��CH=CH2 F��������
��1�������л����л�Ϊͬϵ�����______(����ţ���ͬ)����Ϊͬ���칹�����________��
��2����ϵͳ��������B��������________________��
��3��ʵ������ȡC�ķ�Ӧ�Ļ�ѧ����ʽΪ_________________��
��4����ͼ��ʾ����һ�ֽ���˫ϩ�ϳɵ��л���Ӧ����д�� B �� E����˫ϩ�ϳ����ò���Ľṹ��ʽ____��
![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������Ksp(AgCl)=1.8��10-10mol2/L2��Ksp(AgI)��1.0��10-16 mol2/L2������˵������ȷ����
A. ����ͬ�¶���AgCl���ܽ��С��AgI���ܽ��
B. AgCl��AgI��������ˮ�����AgCl��AgI�����ת��
C. �����£�AgC1��Ҫ��NaI��Һ�п�ʼת��ΪAgI����NaI��Ũ�ȱ��벻����![]() ��10-11mol/L
��10-11mol/L
D. ��������AgCl�ֱ��������������:��20mL0.01mol/LKCl��Һ ��10mL0.02mol/LCaCl2��Һ ��30mL0.05mol/LAgNO3��Һ��AgCl���ܽ���ɴ�С��˳��Ϊ�� ��>��>��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com